MDD简介及申请流程
CE为法文CONFORMITE EUROPEENNE的首字母缩写,表示“欧洲统一”。
CE适用区域
欧盟EU+欧洲经济区EEA+东欧,共31个国家。
很多除欧盟外的国家,除美国FDA、日本PAL、澳大利亚TGA等,绝大数通行欧洲颁发的自由销售证书CFS。
| 法国 | 德国 | 英国 | 爱尔兰 | 意大利 | 比利时 | 荷兰 | 西班牙 |
| 葡萄牙 | 卢森堡 | 瑞典 | 芬兰 | 奥地利 | 波兰 | 匈牙利 | 希腊 |
| 捷克 | 斯洛伐克 | 斯洛文尼亚 | 拉脱维亚 | 立陶宛 | 塞浦路斯 | 马耳他 | 罗马尼亚 |
| 丹麦 | 爱沙尼亚 | 保加利亚 | 冰岛 | 挪威 | 瑞士 | 土耳其 |
CE标志是一种安全认证标志,凡贴有CE标志的产品均可在欧盟各成员国内销售,无须符合各个成员国的要求。使用CE标志,实现了商品在欧盟成员国范围内的自由流通,因此CE标志被视为制造商打开并进入欧洲市场的通行证。
在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求, 加贴“CE”标志必须识别很多协调标准,这是欧盟法律对产品提出的一种强制性要求。
欧盟 医疗器械指令
| 名称 | 指令 | 发布日期 | 生效日期 |
| 医疗器械指令 | 93/42/EEC,MDD | 1993-6-14 | 自1995-1-1起 |
| 体外诊断器械指令 | 98/79/EC,IVDD | 1998-10-27 | 自2000-6-7起 |
| 有源植入器械指令 | 90/385/EEC,AIMDD | 1990-6-20 | 自1993-1-1起 |
欧盟 医疗器械协调标准
| 名称 | 协调标准 | 名称 | 协调标准 |
| 质量管理体系 | EN ISO 13485 | 临床调查 | EN ISO 14155-X |
| 包装 | EN 868-X | 风险分析 | EN ISO 14971 |
| 生物学评估 | EN ISO 10993-X | 标签&符号 | EN 1041 & ISO 15223 |
| 灭菌 | EN 550,552,554,556 | 医用电气安全 | EN 60601-1 |
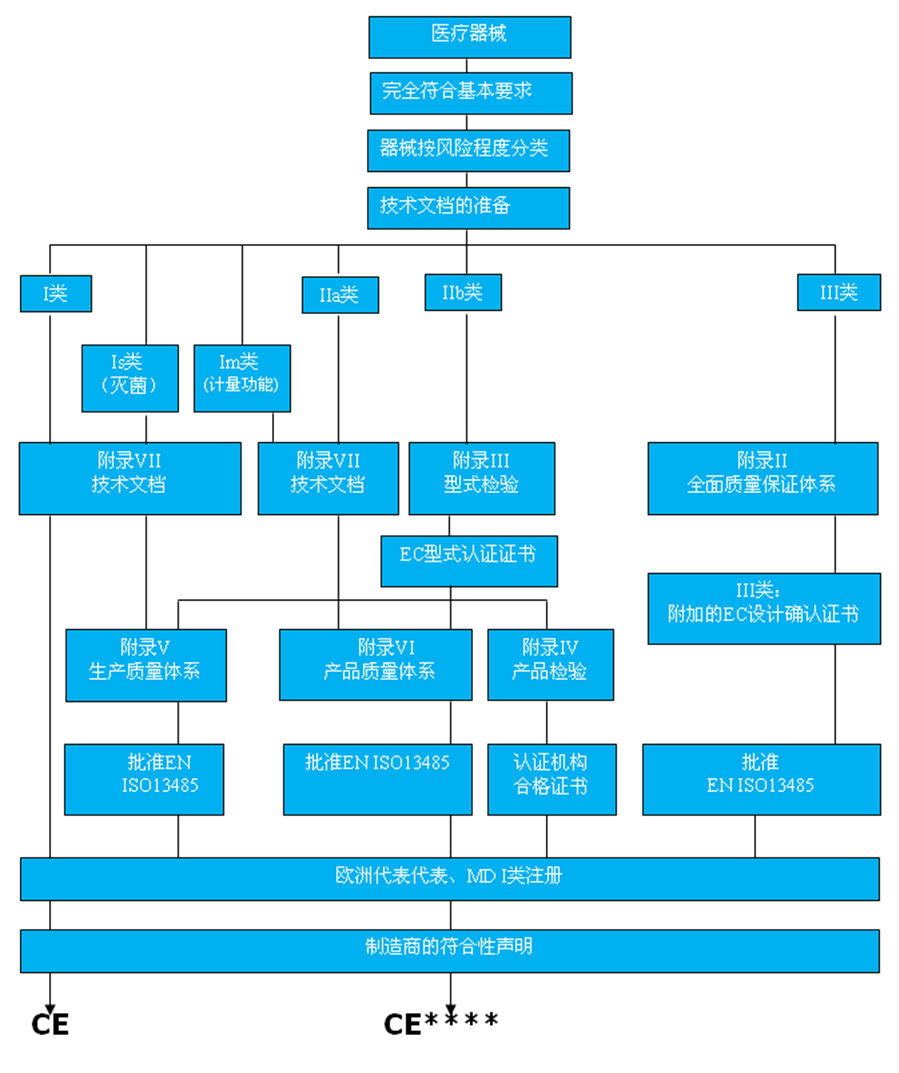
MDD管辖范围内的医疗器械,按其风险大小可以分为四个等级:I类、IIa类、IIb类、III类,其中I类的风险最低,III类最高。 这即是医疗器械的CE分类。
MDD医疗器械进行CE认证时的符合性评估共有9条一般途径及1条特殊途径(适用于系统和程序包),这些途径分别由MDD的第11章、第12章规定。
普通医疗器械CE认证的一般步骤:
1. 分析该器械的特点,确定它所属的指令范围
2. 确定该器械的风险分级
3. 选择相应的符合性评定程序
4. 选择一个公告机构
5. 确认适用的基本要求及有关的协调标准
6. 确认该器械满足基本要求及相关的协调标准, 并使证据文件化
7. 对于需要公告机构评审的器械,通过公告机构的符合性评定程序
8. 起草符合性声明并加贴CE标志
CE 技术文档要求
技术文档是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关调阅,或客户需要时出具。各欧盟指令对于"技术文档"的要求有所差别,在这里仅以中国出口企业最常用的“医疗器械”的要求为例,加以说明。
医疗器械指令93-42-EEC要求“技术文档”可能包含:企业简介及欧洲代表名称、联系方式;CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料),主要内容如下:
1、产品名称、分类及引用标准条款的简要描述
2、产品概述(包括类型和预期用途)
◇ 产品的历史沿革
◇ 技术性能参数
◇ 产品配合使用的附件、配合件和其它设备清单
◇ 产品的图示与样品
◇ 产品所用原材料及供应商
3、使用该产品的协调标准/或其它标准
4、风险管理方面的分析评估、结论和预防措施
5、生产质量控制
◇ 产品资料和控制文档(包括产品生产工艺流程图)
◇ 产品的灭菌方法和确认的描述
◇ 灭菌验证
◇ 产品质量控制措施
◇ 产品稳定性和有效期的描述
6、包装和标识
◇ 包装材料说明
◇ 包装验证
◇ 标签
◇ 使用说明书
7、技术评价
◇ 产品检验报告及相关文献
◇ 技术概要及权威观点
8、潜在风险评价
◇ 产品潜在风险测试报告及相关文献
◇ 潜在风险的概要及权威观点
9、临床评价
◇ 产品临床测试报告及相关文献
◇ 临床使用概述及权威观点
附1、产品出厂检测报告
附2、产品型式检测报告
附3、基本要求检查表
备注:
◇ 临床研究(包括:物理性能,生化、药理及毒性研究,功效测试,灭菌合格证明)
◇ 生物相容性测试(A)第一部分要求:细胞毒性、致敏、刺激、皮内反应、全身毒性(急性毒性)、亚慢性毒性(亚急性毒性)、遗传毒性、植入、血液相容性; (B)支持测试:慢性毒性、致癌性、生殖与发育毒素、生物降解。)
◇ 临床资料(需要临床研究或描述临床研究)
◇ 包装合格证明
◇ 标签、使用说明
◇ 结论(技术文档的接受、利益对应风险的陈述)