欧盟委员会公布第六次MDR和IVDR申请和获证情况调查结果(截至2023年10月),其对于了解医疗器械过渡状态,以预见和防止医疗器械的市场混乱而言至关重要。
MDR和IVDR申请和获证数据
与2023年6月获得的数据以及我们往期文章中数据相比,MDR和IVDR申请数量有显著增加。
2021年2月至2023年10月,MDR公告机构收到近1.8万份申请并颁发约5.6万份产品证书和1万多份QMS证书。
与此同时,IVDR公告机构收到的申请数量从249份增加到1.5万份,而签发的证书数量从7份增加到702份。
2023年10月数据显示,非欧盟群体中的公告机构客户数量略高,其中53%的MDR制造商和57%的IVDR制造商位于欧盟以外。
公告机构签约情况
大多数情况下,制造商提交申请、与公告机构签订书面MDR认证协议,两者相隔不到2个月。
上述信息对期望享受MDR过渡期延长的制造商较为关键:根据延期法规要求,制造商应当在2024年5月前提交申请,并在2024年5月前与公告机构达成书面协议。

MDR和IVDR申请被拒原因分析
在申请被拒的最常见原因中,公告机构表示“超出公告机构的指定范围”、“申请不完整”和“产品资格/设备分类错误”。然而,在已接受的申请中,文件不完整的比率仍然很高。
MDR公告机构特别指出以下原因:
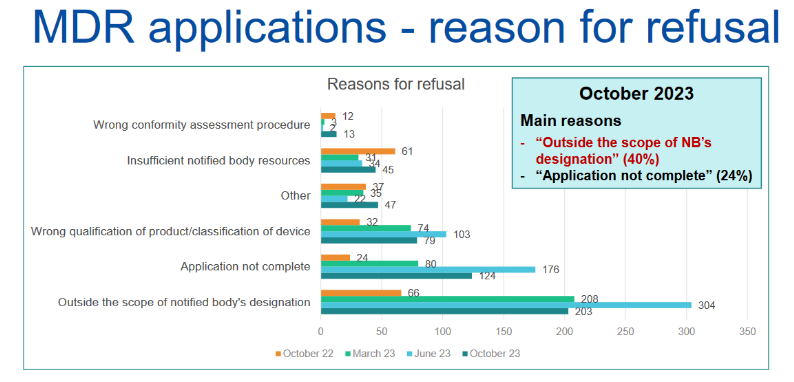
提醒:医疗器械制造商应当考虑获得新认证所需的时间。
当前MDR认证和IVDR认证周期需要13到18个月,该比例占比高达67%。
鉴于延长IVDR过渡期的提案和已确定的MDR过渡期延长,对遗留器械厂商而言,为过渡做好准备并及时联系公告机构显得举足轻重。
>>以上内容为初步报道,请持续关注久顺的后续报道!
→ 欧盟CE证书办理,快·准·好的秘诀是什么?
√ 答案是久顺!始创于1996年,荷兰\英国\美国\中国均设公司,近30年全球合规技术专家,全程高效的欧盟合规服务: CE注册取证\技术文档编写\合规策略\体系辅导\上市后监督咨询\近20年资深欧代\临床方案设计和临床试验方案等。








 沪公网安备 31011502005499
沪公网安备 31011502005499