一、什么是警戒系统?
定义:医疗器械事故(Incidents)和现场安全纠正措施(FSCA)的通知和评估系统。
目的:各欧盟成员国间直接、尽早且统一地实施现场安全纠正措施FSCA,即:通过收集医疗器械相关的上市后事故、不良事件的信息,在适当情况下分发或传播此类信息,以防止不良事件再次发生。
指南:MEDDEV 2.12-1rev 8 GUIDELINES ON A MEDICAL DEVICES VIGILANCE SYSTEM 医疗器械警戒系统指南
二、是否上报警戒系统?
如果医疗器械的特性和性能下降或使用说明书中的任何不足,可能导致或已导致患者\使用者的健康状况恶化或死亡,以及制造商出于安全原因将医疗器械撤出市场,制造商或欧盟授权代表有义务通知主管机构。
·必须上报主管机构的情况
必须同时满足以下三个条件:
■ 事件已经发生;
■ 正常使用器械情况下发生的严重事故;
■ 发生严重事故,包括:健康恶化、死亡、严重公共健康威胁等。
·无需上报主管机构的情况
■ 使用前器械已存在缺陷;
■ 因患者自身原因导致事故;
■ 器械超过使用期限;
■ 器械被不正常使用;
■ 发生故障,但已发出实时警报;
■ 已预期将发生的副作用;
■ 发生概率微小,且未发生健康恶化、死亡等危害结果。
三、如何上报警戒系统?
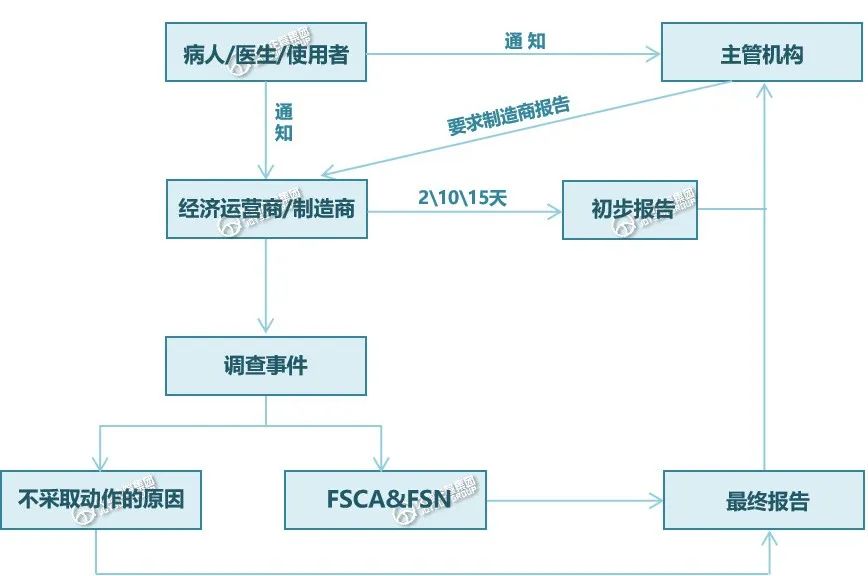
1.事故通知将通过非专业人士、经销商、医疗保健专业人员、主管机构发送给制造商;
2.收到事故通知后,制造商必须首先向主管机构发送初步报告,报告时限如下↓
■ 严重公共健康威胁: 2天;
■ 死亡或无预期的严重健康恶化事件: 10天;
■ 其他严重事件: 15天。
3.制造商有义务针对报告事件开展调查;
4.调查可能导致制造商进行事故风险评估,并通过现场安全通知(FSN)立即对使用者实施现场安全纠正措施(FSCA);
5.制造商向主管机构提交最终报告,说明所采取纠正措施,并向使用者发出安全警报;
若制造商未对事故报告采取措施,则该制造商必须在提交给主管机构的最终报告中提供正当理由。
注意: 所有报告应以电子方式上传至Eudamed系统,向公众公布。
# 警戒系统和上市后监督,均是CE所需质量体系的重要构成。
>> 如需体系建立\培训\升级等服务,可咨询[久顺企管集团]。
> 久顺已为诸多制造商完成MDR/IVDR体系升级、公告机构体系监督审核的MDR/IVDR发补意见,已建立完备的MDR\IVDR体系升级服务:GAP分析表、上市后监督系统、警戒系统等。
> 具体服务项目有:上市后监督计划PMS Plan、上市后性能/临床跟踪计划PMPF\PMCF Plan、趋势报告Trends Report、定期总结报告 Periodic Summary Report等记录报告的建立\执行\培训。








 沪公网安备 31011502005499
沪公网安备 31011502005499