喜报又又又传来,6月圆满收尾、下半年精彩开启!
6月末,久顺企管集团为制造商成功完成:II类血压计产品的传统510(k)申请!仅仅用时87天便超前完成审核。

快&好&省,FDA合规“三好学生”!
久顺企管此次辅导国内医疗器械企业,以超快速、零负担、低成本完成传统510(k)申请,不折不扣地诠释了快\好\省的真正含义!
快:传统510(k)的审核时间为90天,但本次久顺完成整个项目仅用时87天,比官方时间还提前3天。
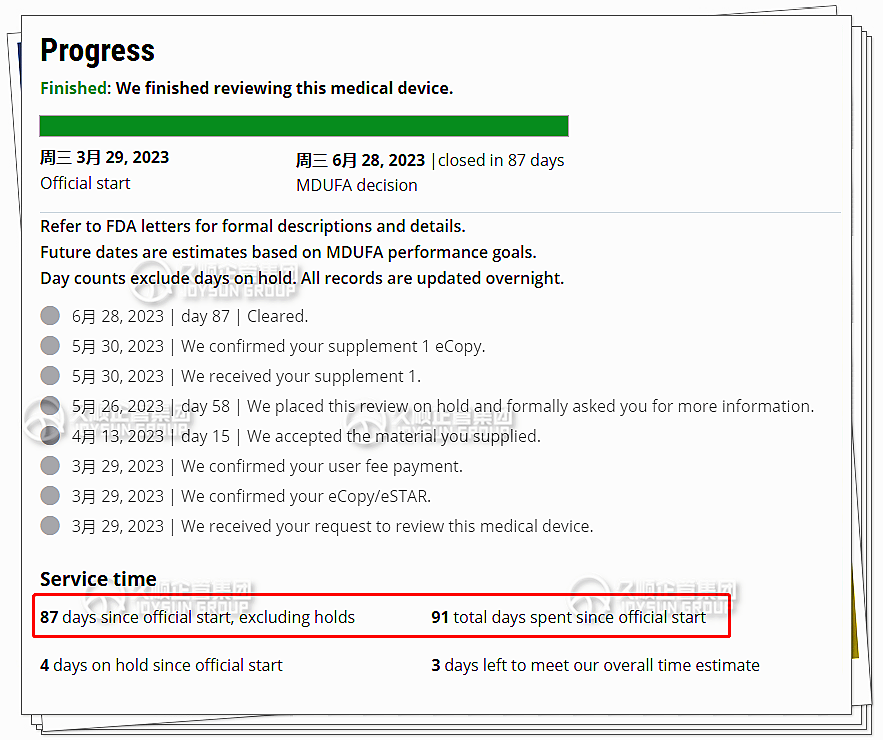
好:久顺技术团队,提供传统510K适用性的专业评估,久顺企管为客户量身打造零负担510K文档,使客户全过程毫无压力、轻松过审!
久顺企管主打的就是一个“陪伴”,是企业合规旅程中值得信赖的好伙伴,不仅为企业出谋划策,更为企业合规道路保驾护航!
省:根据2023财年收费标准,传统510(k)需支付19,870美金,小微企业4,967美金。
久顺企管提供一站式全程服务,可辅导企业完成小微企业申请,充分享受小微企业优惠福利。
“生物相容性”,成功破解510(k)申请一大难点!
不同于性能测试关注器械物理安全性,生物相容性则关注器械制造材料安全性。
为确保医疗器械的质量及临床使用的安全、有效,必须对其生产过程所涉及非活性材料进行生物相容性评价,以用于生产工艺过程的监控和最终产品放行。
可见,生物相容性评价研究是医疗器械产品研发和注册技术审评的一大重点。
1.生物相容性评价的原则
生物安全性原则:安全、科学、有效。
目的在于消除生物材料对人体器官的破坏性,比如细胞毒性和致癌性。
另外,由于生物材料对宿主(使用者)而言为异物,所以在宿主(使用者)体内会产生某种应答或出现排异反应。
生物材料如需确保安全,至少需使得发生的反应能被使用者接受,不会产生有害作用。
生物功能性原则:相容、安全、有效。
生物功能性是指在特殊应用中“能够激发宿主(使用者)恰当地应答”的能力。
随着对生物材料生物相容性不断深入研究,人们发现不仅需要对生物材料毒副作用开展评价,还应进一步评价生物材料对生物功能的影响。
2.生物相容性的分类
血液相容性:材料用于心血管系统,与血液直接接触,主要考察与血液的相互作用。
血液相容性要求:抗血小板血栓形成\抗凝血性\抗溶血性\抗白细胞减少性\抗补体系统抗进性\抗血浆蛋白吸附性\抗细胞因子吸附性。
组织相容性(一般生物相容性):材料与心血管系统以外的组织和器官接触,主要考察与组织和器官的相互作用。
组织相容性要求:细胞黏附性\无抑制细胞生长性\细胞激活性\抗细胞原生质变化性\抗炎症性\无抗原性\无诱变性\无致癌性\无致畸性。
3.生物相容性评价的试验项目
可按照医疗器械接触人体的部位(如皮肤、黏膜、组织、血液等)、方式(直接接触、间接接触或植入)、时间(短时、长期和持久)和用途作分类,一般生物相容性试验项目如下表 ↓
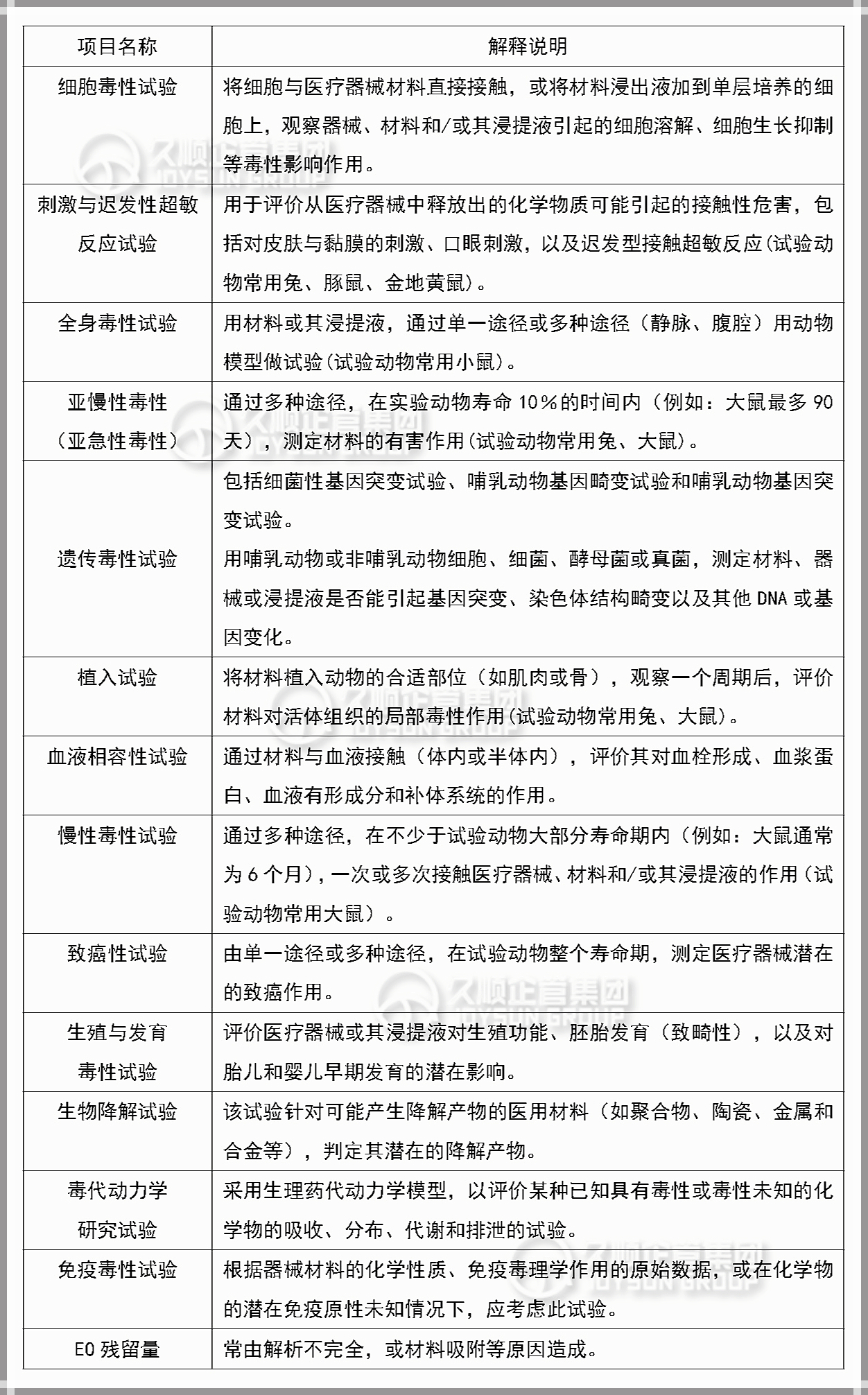
注意>> 虽然测试项目较多,但并非所有产品都需要进行全套测试项目,应主要根据产品使用方法及产品作用性能共同决定所需测试项目。
企业申请510(k)成功率,要领往往在于:其第三方咨询公司是否具备丰厚扎实的510(k)实操经验、擅长510(k)检测的实验室、提供510(k)全程系统服务。
>>【久顺企管集团】是您的明智之选!近30年全球合规技术服务专家\资深美代,美国\荷兰\英国\中国均设公司,成员超80%本科\硕士\博士比例,海外留学经验,无障碍英语口语和书面交流,一站式高效率FDA合规服务:法规符合性咨询及培训\证书获取\临床试验一站式CRO服务\QSR820体系建立维护\FDA验厂咨询\美国授权代表等。
具体优势服务项目有:
1.FDA官网企业账户的年度注册、产品列名、产品上市前批准(510K、豁免510K),维持企业账户的活跃状态;
2.邓白氏码查询、激活获取;
3.产品分类、产品代码的查询配对;
4.申请创建FDA UDI-DI、GUDID账户;
5.GUDID数据库录入医疗器械关键信息。





