上海器审中心公告 | 减免二类体外诊断试剂注册体系申报纸质材料
[2023-06-19]
近日,上海市药监局发布公告显示,为提升注册申报便捷程度,提升申报效能,上海器审中心对二类体外诊断试剂产品注册体系申报纸质资料进行精简和调整。详情摘录如下:
注册申请人需根据本次拟申报产品的具体情况进行自查,对照15个自然日以内(以申报日期计算)已提交注册申请的产品资料,如《CH6A第6A章——质量管理体系文件》和《CH6B第6B章——申报器械的质量管理体系信息》两部分内容与已提交注册申请产品的资料全部或者部分一致,可做出一致性承诺书(见附件),免于提交该部分资料;若存在不一致情形,请在本次申报资料中提交相应的资料。
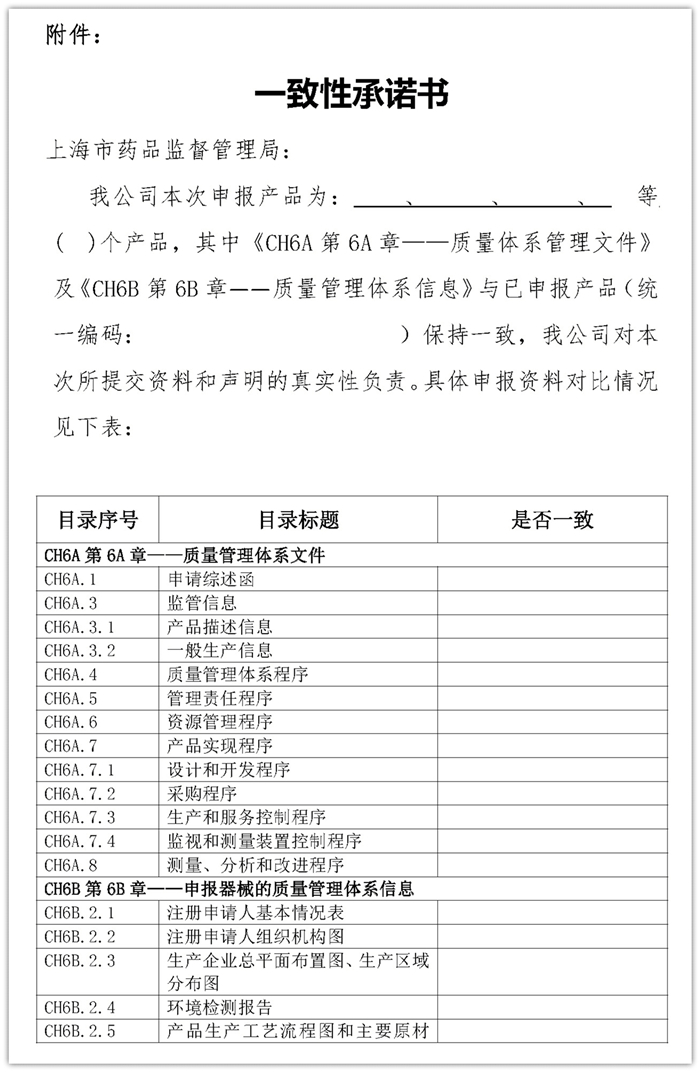
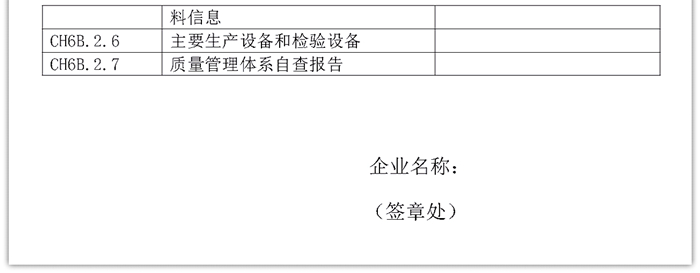
内容来源:上海市药监局官网
声明:该文章为转载,其版权归原作者所有,内容仅代表作者观点。转载仅用于分享,若涉及文章版权及其它问题,请联系我方删除!


【返回】



