欧盟CE第十八期:IVD产品上市前需要做的验证和测试以及要求
[2021-01-25]


1.背景
根据体外诊断医疗器械第2017/746号(EU)法规附录Ⅰ通用安全与性能要求,器械应具备制造商预期的性能,并确保其设计和生产在正常使用条件下适用于其预期用途。为了确保体外诊断医疗器械的高质量和安全性,制造商应在产品上市前对产品进行性能和安全性的测试和验证,以证明器械符合2017/746号(EU)法规的要求,特别是证明其符合适用通用安全与性能的要求。
2.产品上市前需完成的验证与测试
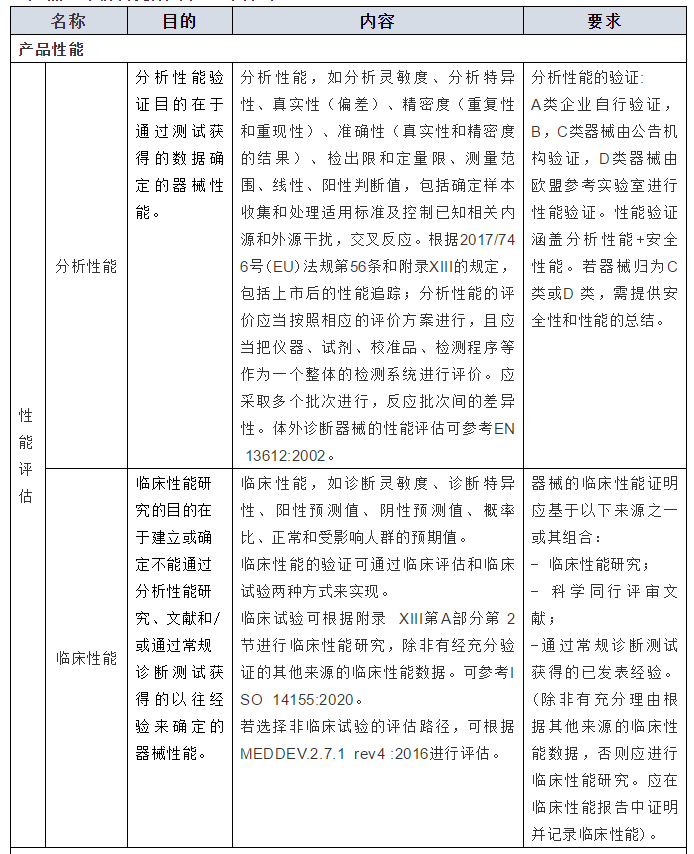
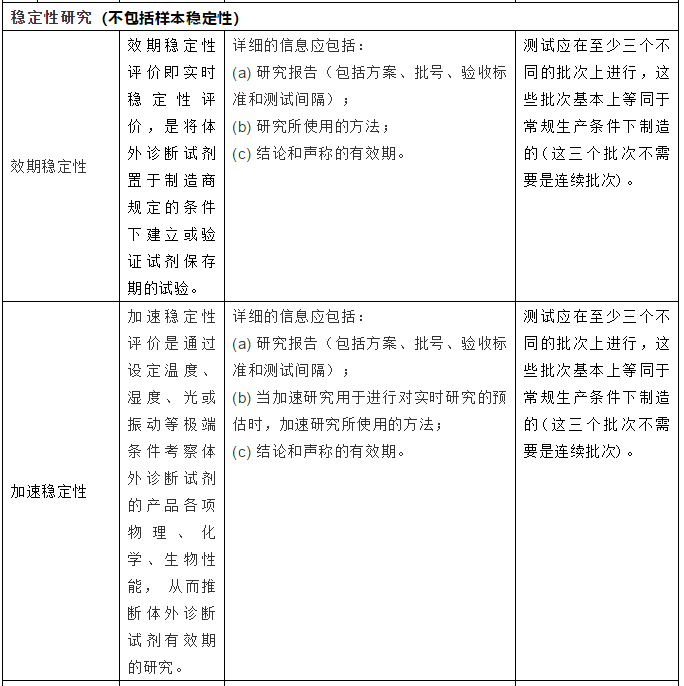
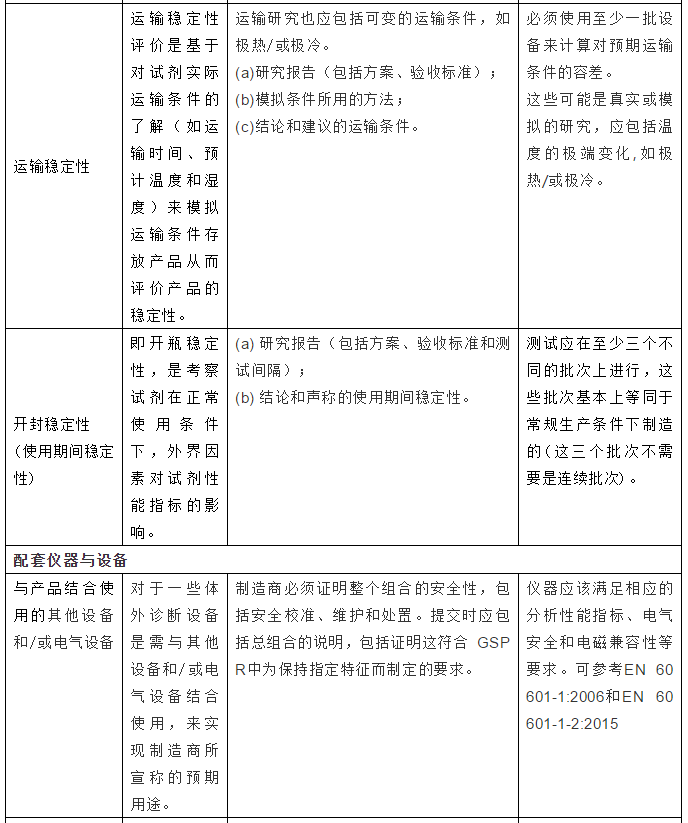
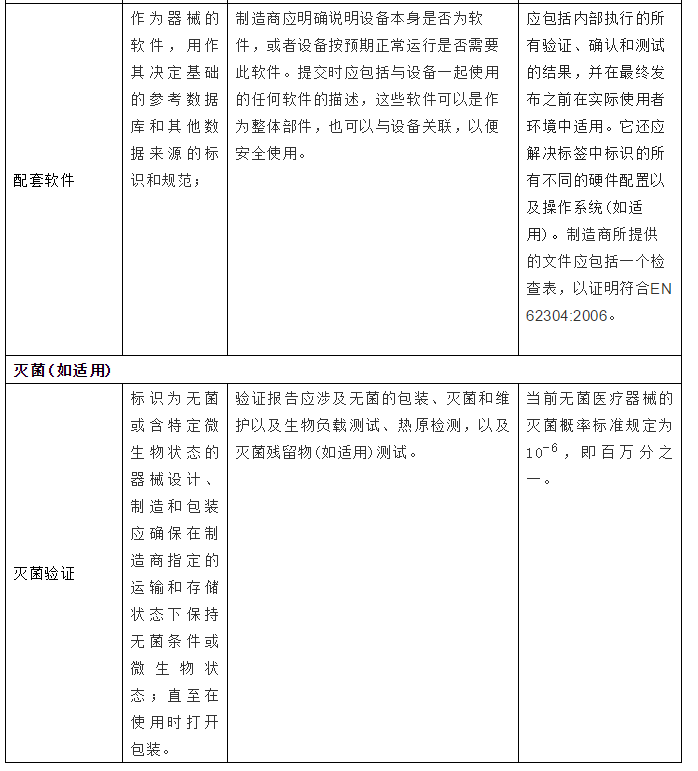
3.总结
体外诊断设备只有经过了一系列的验证与测试并且通过所有的验证与测试,才能保证产品符合器械符合2017/746号(EU)法规的要求,特别是证明其符合适用通用安全与性能的要求。
【返回】



