欧盟CE第十七期:体外诊断IVDR技术文档的要求
[2021-01-18]


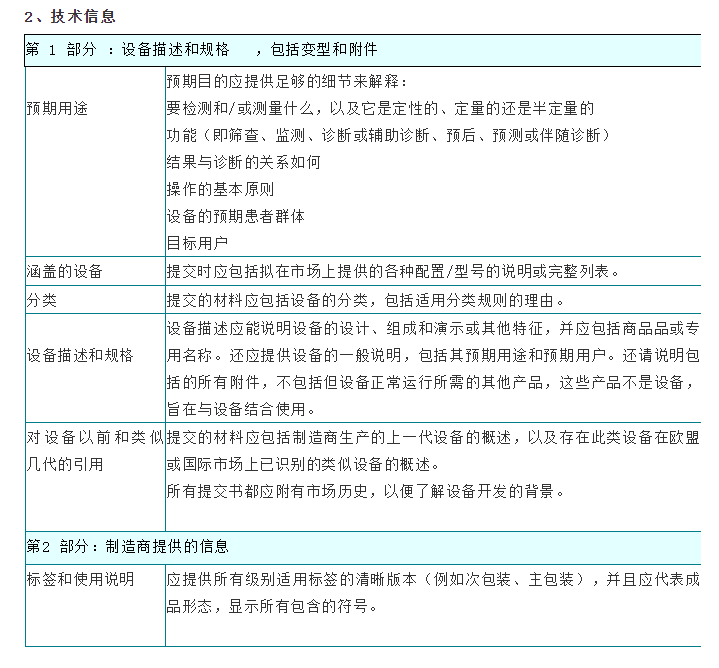
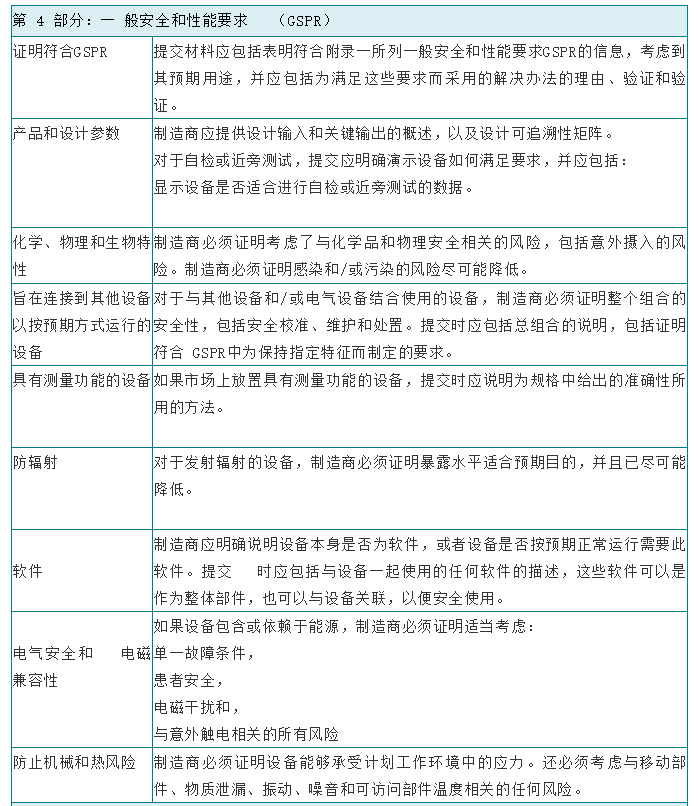
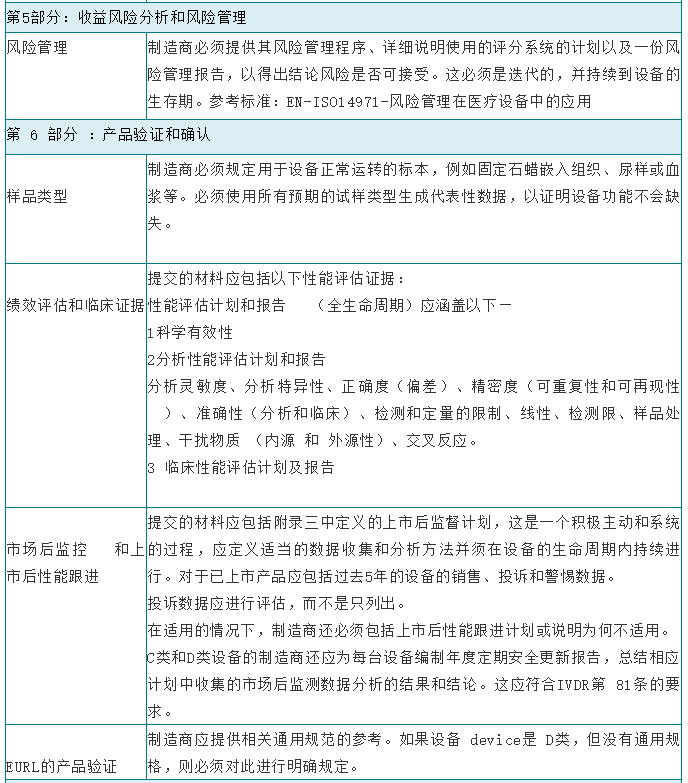
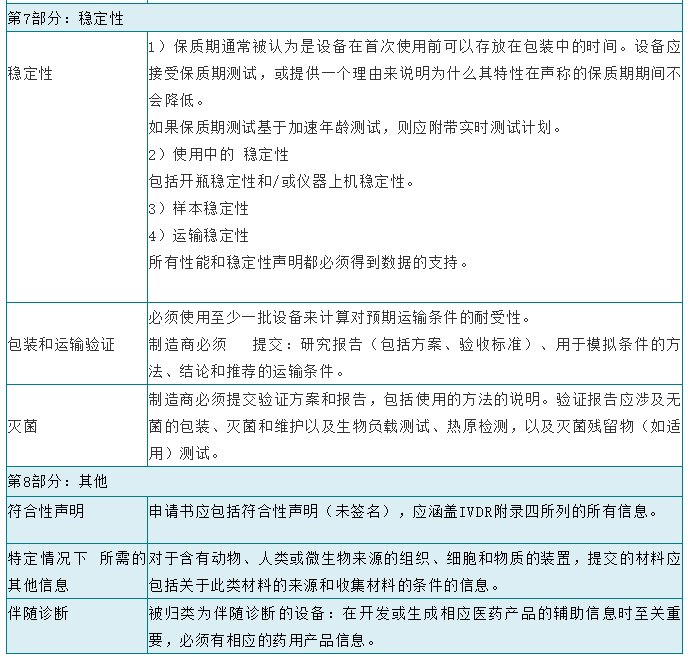
在将体外诊断设备投放市场之前,制造商应按照欧洲议会和理事会体外诊断医疗器械法规2017/746(IVDR)附录九至十一中适用的符合性评估程序对该设备的合格性进行评估。根据分类,大多数设备将需要由公告机构评估其技术文档。技术文档应符合IVDR附件二和附件三中介绍的技术文件的要求,并尽量避免造成技术文件审查延误的最常见原因:1、提交材料不完整;2、技术文档结构差,信息存在但难以找到。下面具体讲一下IVDR技术文档的编制的格式及内容要求:
一、文档格式
1、语言
所有提交的技术文档和测试结果必须为英语。如后期翻译可能会增加费用及审核时间。
2、电子文件格式
1)理想情况下,文档应为分页、可搜索的PDF文件
2)PDF 文件和附件不应受文件保护或锁定
3)文件名应合乎逻辑,并反映该部分中涵盖的信息
4)文档应添加书签,以确保导航方便
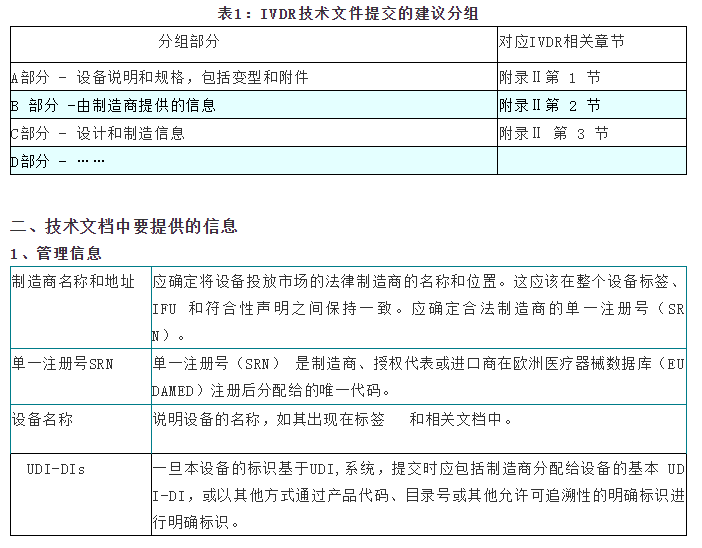
5)对文档进行分组,如表1 所示例子

【返回】



