

MDR 2017/745(后简称MDR)即将到来,在申请MDR下的CE证书时,如何保证质量管理体系能够满足MDR的法规要求是企业开始担心的问题。对于所有的质量管理体系要求,仅遵守ENISO 13485规定的要求并不能完全达到符合性,制造商需要将适用的MDR中对质量管理体系的要求纳入过程中。今天就如何完善现有的质量管理体系介绍,让企业清楚MDR要求下的质量管理体系至少要覆盖哪些内容。
MDR里对质量管理体系的要求主要集中在Article10 制造商职责、Annex I Chapter I、AnnexIX 和 Annex XI。
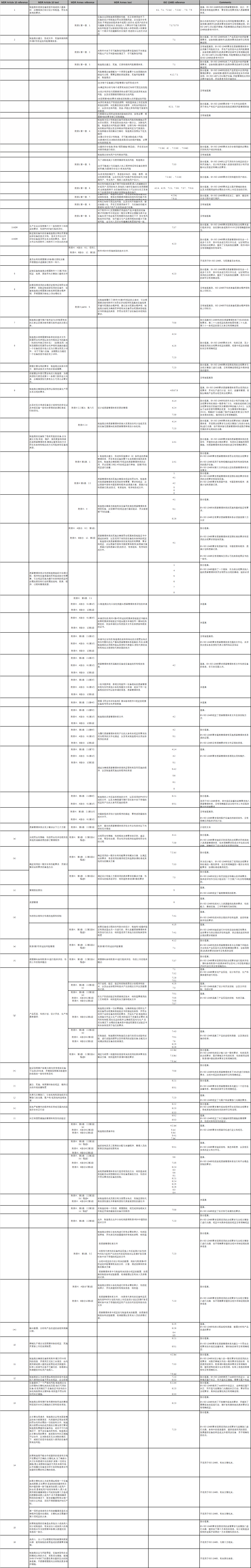
为帮助企业更好地完善质量管理体系,CEN(欧洲标准化委员会)在2018年发布了CEN/TR17223:2018 Guidance on therelationship between EN ISO 13485:2016 and EuropeanMedical Devices Regulationand In Vitro Diagnostic Medical DevicesRegulation. 大家可以看下这份Guidance的表1部分,列明了MDR2017/745和ENISO13485:2016之间的关系。
例如,欧洲法规第15条规定了对“合规负责人”职位的具体要求。虽然这一职位在ENISO 13485中没有明确提及,但它构成了一个需要纳入组织质量管理体系以遵守法规的监管要求。一旦纳入质量管理系统,有关的要求,例如能力、职责和相互关系的定义,将适用于这个职位。
此外,欧洲法规要求在质量管理体系中纳入某些流程,如临床评估、风险管理、上市后监督和分配UDI设备标识。ENISO 13485要求按照法规要求将这些过程整合到质量管理体系中,但未明确包括标准中特定的欧盟法规要求的细节。
表1显示了ENISO 13485条款与MDR的要求之间的关系,以及对该标准的要求涵盖MDR的具体细节的程度的解释,企业可以参照表1的内容完善质量管理体系。
表1- EN ISO 13485条款与欧洲医疗器械法规(欧盟法规2017/745)第10条、附件1第一章、附件IX和附件XI之间的关系
清晰版请参见微信公众号,点上面蓝色标题,直达链接
久顺企管集团(中国 英国 荷兰 美国)为您提供快捷、专业、优质的取证服务。若您有新冠试剂盒、口罩、防护服、护目镜等产品需要出口,久顺为您提供的服务包含:
欧盟:
ISO13485质量体系、CE认证(MDD/MDR/IVDD/IVDR)、欧盟授权代表(EAR)、英国授权代表、荷兰注册(CIBG)、英国注册(MHRA)、自由销售证书(CFS)
中国:
质量体系GMP、临床试验、医疗器械应急审批、办理产品注册证、生产许可证和经营许可证;
美国:
FDA注册、美国授权代表、美国FDA EUA注册、NIOSH认证、美国FDA-QSR820验厂;
其他:
MDSAP单一审核、使馆公证、商会公证和海牙公证等。
联络手机:132-625-99339
免费电话:400-658-3933
我们恭候您的来电咨询!



