

第一期我们讲到“欧盟CE第一期:医疗器械MDR法规、协调标准及认证步骤”、第二期讲到“欧盟CE第二期:医疗器械MDR技术文档的要求”、第三期讲到“欧盟CE第三期:医疗器械MDR产品分类规则”,本期我们来讲医疗器械MDR CE申请流程,申请医疗器械MDR CE证书,申请流程如下:
第一步:确定产品符合的法规和协调标准
确定产品符合的法规和协调标准要求,了解认证流程,请查看第一期。欧盟协调标准用来指导产品满足指令基本要求的详细技术文件。
第二步:对产品进行分类
按MDR的法规要求对医疗器械产品进行分类,MDR 2017/745号法规附录VIII中详定22条规则,按医疗产品的危险程度,将产品分为Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类,请查看第三期。
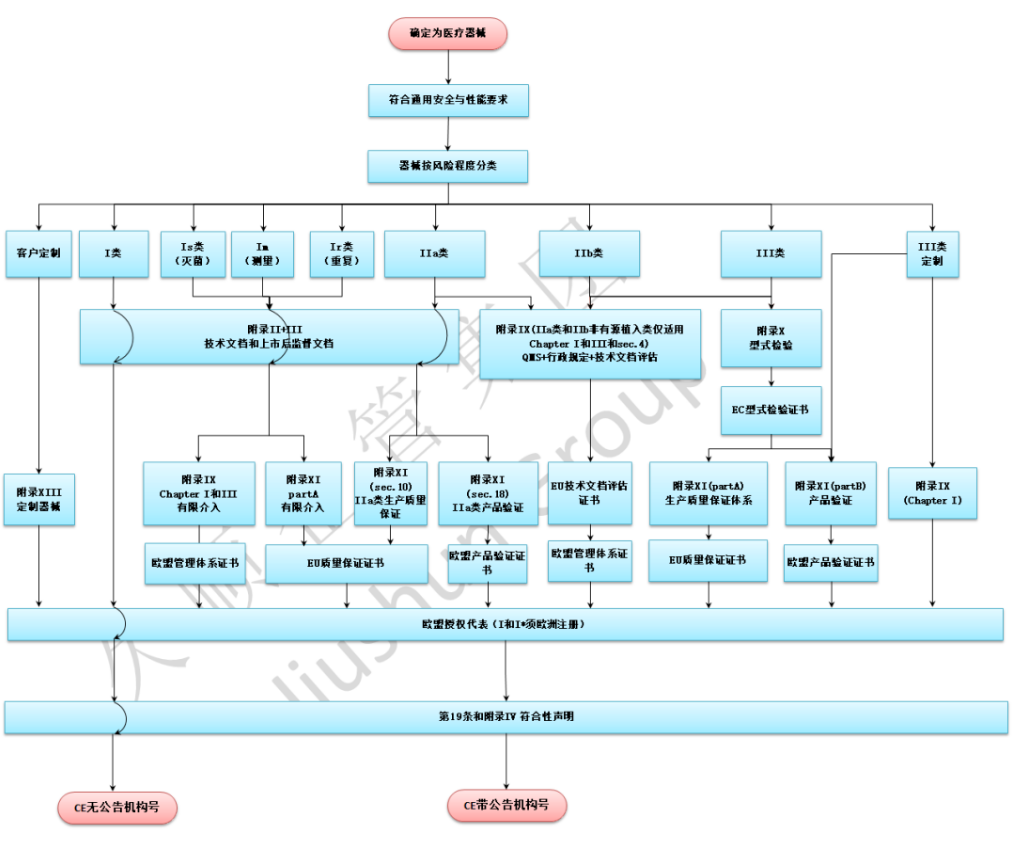
我们在实际的工作时,产品的会细分为Ⅰ类、Ⅰ*类、Ⅱa类、Ⅱb类、Ⅱb植入类和Ⅲ类。其中,Ⅰ*类会包含(Is、Im和Ir),中文为Ⅰ*类会包含(I类灭菌、I类测量和I类可重复)。
根据分类走不同的认证流程,I类产品不需要公告机构参与,做符合性声明DOC和,取得欧盟授权代表在对应欧盟成员国的主管当局进行登记注册的凭证。
I类以上的产品,即Ⅰ*类、Ⅱa类、Ⅱb类、Ⅱb植入类和Ⅲ类产品,需要公告机构参与,审核并颁发ISO13485证书和CE证书。
第三步:建立运行ISO13485质量管理体系
应建立符合欧盟医疗器械法规要求的质量管理体系,体系建立应以ENISO13485:2016/AC为基础,并满足MDR规定的其他要求;I类产品由企业自我声明,并建立质量管理体系,无需公告机构审核,但推荐I类产品生产企业进行ISO13485认证;I类以上产品,即Ⅰ*类、Ⅱa类、Ⅱb类、Ⅱb植入类和Ⅲ类产品,必须要由具有MDR资质的公告机构进行符合性审核并颁发证书。
第四步:开展产品检测,取得检测报告
确定产品在欧盟的所有检测标准,检测时需要确定检测机构的检测资质。如是需要公告机构审核的产品,应和公告机构确定好检测机构颁发的证书是否被认可。产品应通过检测,取得合格的检测报告。
第五步:编写MDR技术文档
制造商必须根据产品所符合的法规要求和协调标准要求,编写MDR技术文档,取得欧盟授权代表协议。MDR技术文档的要求,请查看第二期,I类以上产品的MDR技术文档,即Ⅰ*类、Ⅱa类、Ⅱb类、Ⅱb植入类和Ⅲ类产品,需要通过公告机构审核,审核通过后取得MDR CE证书。
第六步:完成CE符合性声明DOC,加贴CE标志
制造商在完成CE符合性声明DOC后,需要在符合性声明上签字盖章。然后在产品上加贴CE标志,CE标志必须按照其标准图样,清楚且永久的贴在产品或其铭牌上。公告机构颁发CE证书的产品,CE标志上必须带有公告机构的公告号。
经过以上六个步骤,我们的产品便可以加贴CE标志销往欧盟成员国了。
最后:开展上市后的监督跟踪和维护
附上MDR申请流程表,点击下图放大查看:
久顺企管集团(中国 英国 荷兰 美国)为您提供快捷、专业、优质的取证服务。若您有新冠试剂盒、口罩、防护服、护目镜等产品需要出口,久顺为您提供的服务包含:
欧盟:
ISO13485质量体系、CE认证(MDD/MDR/IVDD/IVDR)、欧盟授权代表(EAR)、英国授权代表、荷兰注册(CIBG)、英国注册(MHRA)、自由销售证书(CFS)
中国:
质量体系GMP、临床试验、医疗器械应急审批、办理产品注册证、生产许可证和经营许可证;
美国:
FDA注册、美国授权代表、美国FDA EUA注册、NIOSH认证、美国FDA-QSR820验厂;
其他:
MDSAP单一审核、使馆公证、商会公证和海牙公证等。
联络手机:132-625-99339
免费电话:400-658-3933
我们恭候您的来电咨询!



