《欧盟体外诊断医疗器械法规New IVDR》专题讲座
为帮助广大IVD企业了解欧盟体外诊断医疗器械法规New IVDR相关法规要求,9月25日,CCBio联合BSI和久顺企管集团在上海自贸壹号生命科技产业园举办《欧盟体外诊断医疗器械法规New IVDR》专题讲座。
本次活动,CCBio继续秉承“产业+干货信息分享”这一活动理念,邀请BSI中国区医疗器械总监计利方老师和久顺企管集团宋福明专家团队讲师为大家带来New IVDR专题讲座。
活动同时邀请了全国卫生产业企业管理协会医学检验产业分会、上海医疗器械行业协会、浦东新区科技企业孵化联盟和丁香园等合作伙伴协办本次活动。
上海自贸壹号生命科技园作为联合主办方,是一家医疗器械专业产业园区,提供七大软硬件服务,分别是:共享实验室、共享GMP车间、共享合规化仓储、合规化注册服务、投融资服务、人力资源服务、产品推广服务平台,提供了符合医疗器械注册人制度要求的受托生产平台,以体外诊断IVD为切入点,提供相关的CRO+CDMO服务,为医疗器械创新技术产品的研发注册申报提供一站式解决方案。
本次专题讲座吸引了数十位全国IVD优秀企业代表参会。
计利方 欧盟新IVDR法规介绍
计利方老师,拥有丰富的医疗器械知识、法规和临床经验。在BSI工作十五年,担任质量管理体系高级审核员、高级讲师、医疗器械产品经理、公告机构SchemeManager以及有源医疗器械产品专家等职务,他拥有IRCA & CCAA主任审核员、IRCA高级讲师资格。

计利方老师整体介绍IVDR法规。IVDR法规在2017年5月5号发布,20日之后进入生效期, 2022年5月26号为最终的转版期限,这意味着企业五年之内所有新产品(包括原有自我宣称的产品)必须满足IVDR的要求,才能在欧盟上市销售。对持有IVDD指令的CE证书的产品,在转版截止日之后,可以继续有效最长两年。
进行IVDR的CE认证需要什么?需要有资格的IVDR公告机构来进行认证。欧盟和至少三个成员国的主管当局对申请IVDR资格的机构进行联合审核,公告机构获得IVDR的公告机构的资格之后,才可以向IVD客户提供基于IVDR的CE认证,发放IVDR的CE证书。
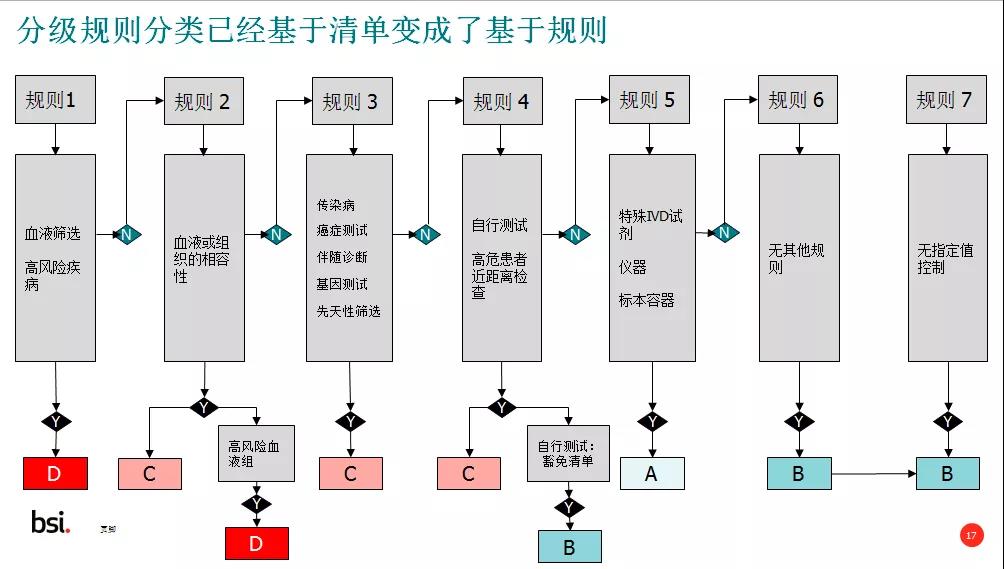
计老师还介绍了法规负责人、IVDR范围、分类、认证途径和临床等方面的变化;IVDR要求任命新的法规负责人,法规负责人需要有四年的医疗器械的专业经验;范围上 IVDR较IVDD没有太大的变化;但分类上变化很大,分类已经从基于清单变为基于规则。分类用A/B/C/D来分类,D类最高,A类为最低的风险。新的IVDR参照MDR的要求,引入了临床(Clinical performance)的要求,这对很多IVD企业也带来了更多挑战。
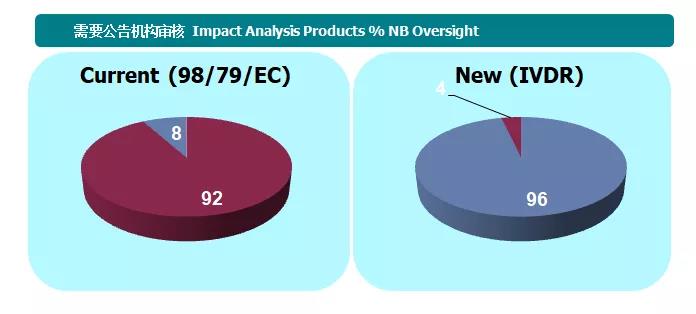
 New IVDR颁发后,对企业和公告机构影响巨大。最直观的表现为需要CE认证的产品范围发生了变化。按照IVDD的要求,需要公告机构进行CE认证的产品只有8%,不需要CE认证的产品有92%;现在新的法规颁布后,数据发生了变化,需要CE认证的产品变成了96%,不需要的为4%。
New IVDR颁发后,对企业和公告机构影响巨大。最直观的表现为需要CE认证的产品范围发生了变化。按照IVDD的要求,需要公告机构进行CE认证的产品只有8%,不需要CE认证的产品有92%;现在新的法规颁布后,数据发生了变化,需要CE认证的产品变成了96%,不需要的为4%。
宋福明专家团队 如何应对欧盟IVDR新法规
宋福明专家团队讲师是久顺技术骨干的一员,宋福明带领久顺企管集团专家团队咨询、辅导、培训超过3000家医疗器械公司通过CE、ISO13485、ISO9001、CFDA注册、FDA注册、FDA验厂、欧洲MHRA注册、自由销售证书CFS及欧洲公证等认证项目。宋福明所领导的久顺企管集团,20多年来获得业界广泛赞誉。

宋福明专家团队的讲师阐述的内容更加落地,IVDR施行后,IVD企业质量体系如何满足法规的要求,如何做好过渡期的准备工作和应对欧盟IVDR的其他新法规要求等。
宋福明专家团队的讲师指出,IVDR相对IVDD的差异表现在:
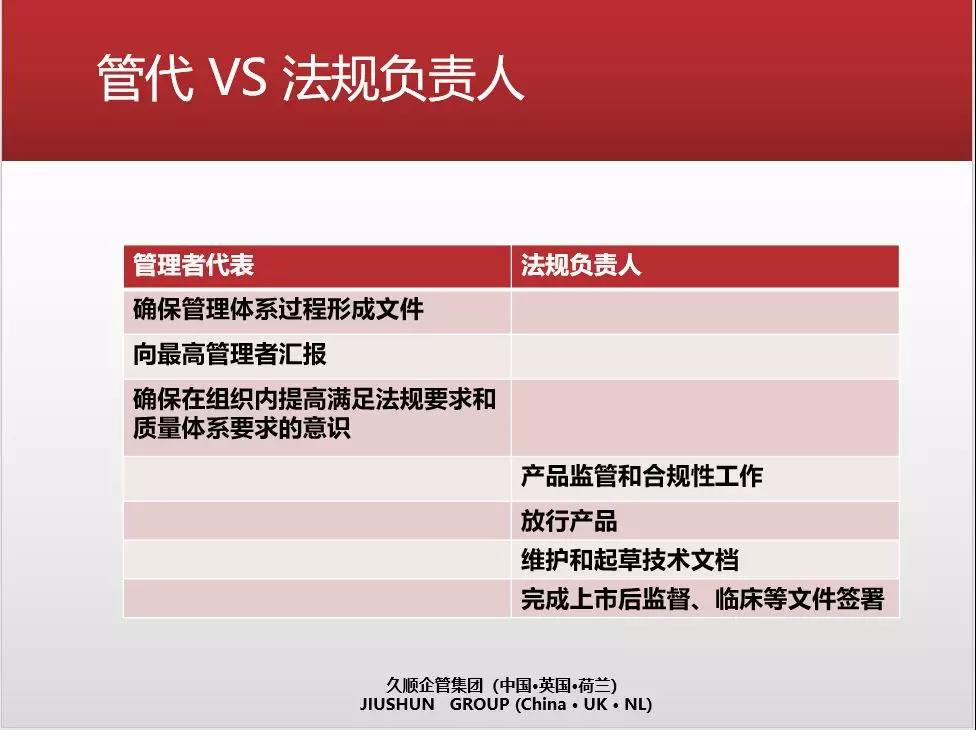
• 从法律层面明确规定一个职责人。这个职位不同于管代的职责但类似于国内法规要求下的管代职责加产品放行人职责。
• 对管代和法规负责人进行对比
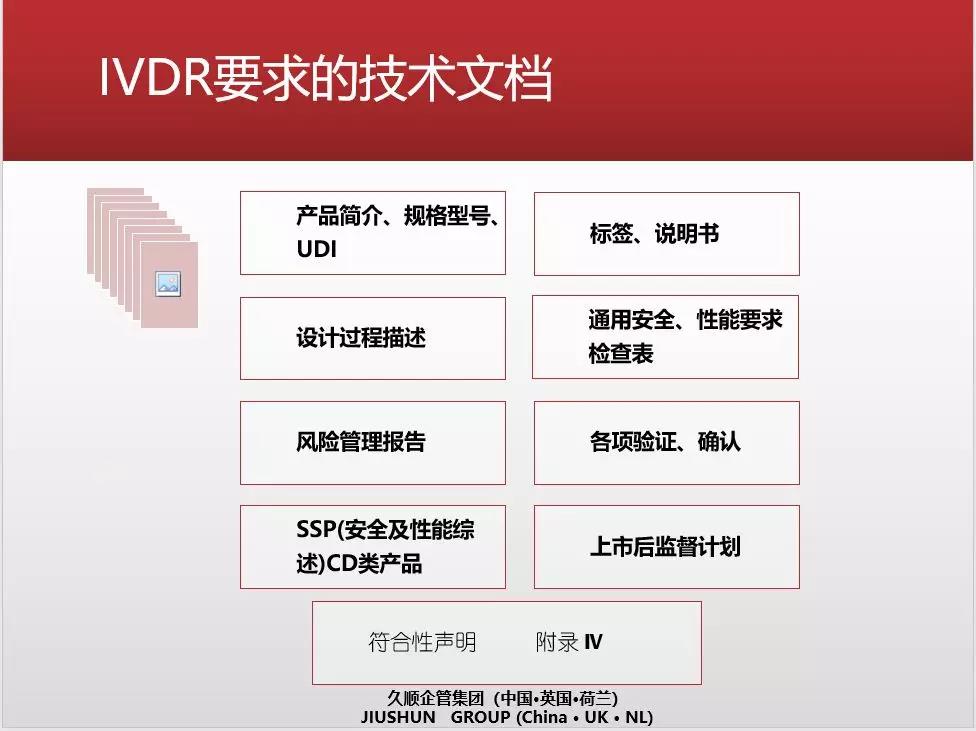
• IVDR要求的技术文档要求。附录 II对技术文档到底要提供哪些信息做出了明确的规定,看起来没什么,但是要求是非常高的。调整技术文档以符合IVDR要求的工作量,会超乎大家想象。
• 临床评估。宋福明专家团队讲师指出,在技术文档中,最难、最让厂家头疼、最能证明产品安全有效性、对文件撰写者要求最高的是临床评估。这里的临床评估不是简单的对比实验,而是要求制造商持续更新SSP和PMS报告的职责,以后文件中的上市后监督计划不再是写写而已的形式化的内容,是需要切实去落实收集上市后信息的。临床评估时需要切实采用科学的统计学方法来判断有效性,如汇集较多小样本进行荟萃分析等。
产品认证主要由两部分构成,CE和EN ISO13485。一个是证明产品安全有效性,另一个证明能持续输出产品文档。
所以质量管理体系同样至关重要!
管理体系的基本要求是:
体系文件结构依靠质量手册,程序文件,管理文件、作业文件、质量记录,三级文件进行管理。以文件管理为例,文件管理包括文件的编制、文件的发放管理、文件的回收/作废和销毁、记录的管理、文件的保存管理。这要求文件必须是真实受控。
最后,宋福明专家团队讲师对如何做好过渡期的准备工作,给出了以下建议:


此次会议还特别设置了观众与讲师的互动环节,讲师们对于企业在操作过程中遇到问题进行了专业解答。会议得到与会人员的一致认可。