本期导读:
本文概述了目前医疗器械技术审评过程中开展临床试验的产品的数据分析情况,提出了企业提交资料中临床试验数据统计分析存在的主要问题,从统计学的角度给出了不同类型产品的试验数据统计分析方法建议,为技术审评人员和临床试验数据统计分析人员提供技术参考。
1、监管法规规定
临床试验是证明产品安全性有效性的重要途径和手段。医疗器械临床试验是指在相应的临床环境中,对拟申请注册的普通医疗器械在正常使用条件下的安全性和有效性进行确认或者验证的过程,或对体外诊断试剂的临床性能进行系统性研究的过程。
《医疗器械监督管理条例》(中华人民共和国国务院令第650号)规定第一类医疗器械不需要进行临床试验,第二、三类医疗器械注册应当进行临床试验。部分产品可免于进行临床试验,免于进行临床试验的医疗器械目录由国家食品药品监督管理部门制定、调整并公布。临床试验应在有资质的临床试验机构进行,医疗器械临床试验机构由国务院食品药品监督管理部门会同国务院卫生计生主管部门认定并公布。
在没有发布目录之前,体外诊断试剂申请人应当在省级医疗卫生机构开展临床试验。对于特殊使用目的的体外诊断试剂产品,可以在符合要求的市级以上的疾病控制中心、专科医院或检验检疫所、戒毒中心等机构开展临床试验。第三类体外诊断试剂申请人应当选定不少于3家(含3家)临床试验机构、第二类体外诊断试剂申请人应当选定不少于2家(含2家)临床试验机构。
一般第三类体外诊断试剂总样本量至少为1000例,第二类至少为200例。另外,对于一些特殊情况会有不同的最低样本量要求。体外诊断试剂的样本量与样本分布,在符合有关最低样本量要求的前提下,还应符合统计学要求。普通医疗器械临床试验应当在两个或者两个以上有资质的医疗器械临床试验机构中进行,样本量应符合统计学要求。
医疗器械临床试验的方案和报告中都应明确试验所采用的统计学方法和评价方法。
2、统计分析存在的主要问题
医疗器械的种类繁多,临床实验设计和统计方法选择存在较大差异。
2.1 统计报告资料
临床原始数据不完整。很多临床统计报告没有按照法规要求提交完整的临床原始数据,例如完全不提交原始数据、只提交部分病例的原始数据、原始数据中病例信息不完整(缺少病历号、人口学信息、临床诊断等)、原始数据无操作人复核人签字、无医疗机构盖章等。
不提交比对产品的说明书。说明书包含着产品性能、参考区间等重要信息,直接影响统计分析结果,是统计报告资料的重要组成部分。
2.2 临床试验设计方案
缺少合理的样本选择依据、入选标准、排除标准和剔除标准。这一点往往会导致样本选择不合理或不全面,例如没有结合产品预期用途和疾病发病率入选有相关疾病背景的病例,入选的样本不能完整覆盖定量产品的线性范围或缺少定性产品检测灰区附近的样本。
方案和报告的描述有差异,特别是样本量。很多临床试验会出现方案规定共入选100例样本,其中阳性样本不少于30%,而报告中样本数却不足或大于100例,阳性样本率达不到30%等。
临床试验中采用的试验机型不是产品的适用机型。部分临床试验采用的试验机型不是待考核产品或比对产品的适用机型。这涉及到试剂和仪器的系统匹配性,影响试验结果及统计学意义的判定。
各分机构之间方案不一致,如两家临床机构所使用的对照产品或适用机型不一致。分机构方案的不一致性会影响合并分析的适用性。若忽略这一点,则会导致总结报告不可接受。
2.3 统计分析方法
没有对样本的人口学资料进行描述分析。很多临床试验报告都没有对受试样本的人口学资料进行描述。特别是性别或年龄等会影响产品的参考区间从而影响阴阳性的判断,报告没有进行分开描述和分析。
统计方法单一,不全面。目前医疗器械(含体外诊断试剂)临床试验数据分析采用的统计方法较为单一和模板化,而缺少对数据特征和研究目的综合考虑下的个性化分析。常用卡方检验、t检验、线性回归、符合率计算、Kappa一致性检验等,很少用秩和检验、误差分析、Bland-Altman分析、ROC曲线等更有说服力的统计方法。报告中一般缺少异常值检查、误差分析等数据可用性分析结果。
统计方法采用前没有进行适用性条件判断。统计方法的应用都需要满足不同的前提条件,例如配对t 检验要求两独立样本的差值d变量服从正态分布,线性回归模型要求满足线性、独立、正态、等方差4个条件等。临床试验报告一般不对适用性进行判断,或不提交判断资料,直接呈现统计结果。
计量资料转换成分类资料时,缺乏转换依据的描述。在计量资料与分类资料比较,或者计量资料间相比较时,很多报告会将计量资料转换成分类资料,绘制四格表,做符合率分析。但是在做数据类型转换的时候,报告中往往缺乏转换依据的描述,例如产品参考区间。特别是当考核试剂和比对试剂的参考区间不一致时,很多报告没有分开区别转换。
配对设计试验中,对检测结果不一致的样本的处理。很多临床试验对检测结果不一致样本的处理没有做出相关规定,例如没有规定所采用的第三方试剂复核,或与金标准判断结果进行比较。另外,有些试验对检测不一致的样本进行了复核或比较,但是对不一致产生的原因没有做进一步的分析。
统计分析表述不规范或有误。部分临床试验报告中会出现四格表绘制不规范,甚至表内数据错误,与原始数据不符的情况。
总结报告没有合并分析。部分临床试验总结报告没有汇总各分机构的原始数据进行合并分析,只是将分机构的结果做一个简单重复表述。
3、统计分析方法建议
医疗器械的门类、功效非常多,为应对特定医疗器械的功效,应根据产品特点进行相应的科学设计,统计分析方法需结合研究设计类型和资料特征进行选择。
3.1 统计分析的一般要求
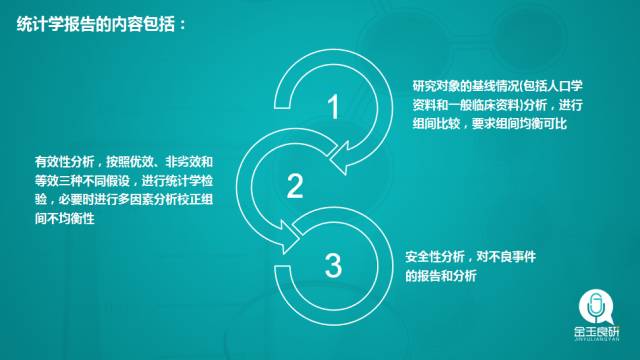
应规范和完整报告临床试验的情况,除了对效应指标进行评价的核心统计分析内容外,还应完整报告如下内容:研究对象的基本情况(至少包括但不限于性别、年龄和疾病名称),以帮助评价研究对象入选的科学性和代表性;前瞻性研究要进行基线情况分析和脱落情况分析,报告全分析集(FAS)、符合方案集(PPS)和安全性分析集(SAS)的例数关系,并按照填补规则分别进行统计分析。应对统计方法的适用条件作判断,保证统计方法选择的正确。注意统计图、统计表表达的规范性和互补性。
表1列举了常见医疗器械临床试验统计分析方法,下面分别加以说明。
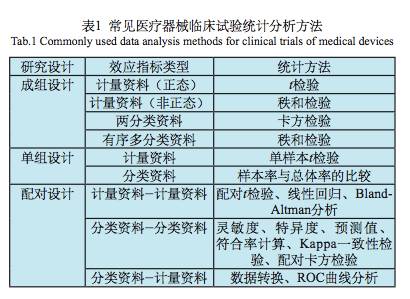
3.3 单组设计的医疗器械统计分析方法
因伦理考虑要求,有些医疗器械的临床试验不必采用对照试验,而可以采用单组试验目标值法。单组试验应采用单组的测量值与目标值进行比较的统计分析方法。建议采用的统计分析方法原则为:如果效应值为计量资料可采用单样本t检验;如果为分类资料,可采用单组率与总体率比较的检验方法。同时采用可信区间法,计算单组率或单组均数的95%可信区间,将可信区间的上下限值与目标值进行比较,如果区间包含了目标值,则二者间差异无统计学意义,否则差异有统计学意义。

3.4 配对设计的医疗器械统计分析方法
评价诊断功效的医疗器械临床试验绝大多数采用配对设计,即将两种需要比对的诊断用医疗器械对同一研究对象进行测量,比较两个测量值的一致性。应根据测量值数据特征的不同选择不同的统计分析方法,建议的统计分析原则为:如果试验和对照医疗器械的测量值均为分类资料,则采用计算灵敏度、特异度、Kappa-致性检验、配对χ2检验等方法进行分析;如果试验和对照医疗器械的测量值均为计量资料,则采用配对t检验、线性回归、Bland-Altman分析等方法进行分析;如果试验医疗器械的测量值为计量资料,对照医疗器械测量值为分类资料,则可采用 ROC曲线分析,用ROC曲线下面积大小表示诊断效能,并计算临床诊断cut-off值;如果是一端或两端存在不确切值的情况时,可将确切值部分(线性范围) 按照计量资料比较的方法处理,不确切值部分按照分类资料的方法进行分析;也可以进行资料特征转换,将计量资料、不确定值的资料统一转换成分类资料,再进行分析。

综上,在医疗器械产品上市前的技术审评过程中,临床试验对验证产品安全有效性起到至关重要的作用。其中,临床试验方案制订的合理性,尤其是统计分析方法选择的正确与否,是临床工作开展的基础。本文是笔者在技术审评过程中发现的具体实际问题及临床试验统计过程的经验汇总,从统计学的角度给出了不同类型产品的试验数据统计分析方法建议,希望能够为技术审评人员和临床试验数据统计分析人员提供技术参考。
作者:杨笑鹤,何琼,甄辉 浙江省医疗器械审评中心,
季聪华 浙江中医药大学附属第一医院
选自:中国医疗器械杂志 临床医学工程 2017年41卷 第1期
久顺企管(中国●英国●爱尔兰),FDA验厂和医疗器械认证专家:400-658-3933,随时随地聆听您的需求!



