FDA最新发布GUDID Data Trends,总结GUDID数据的模式和趋势,包括提交至GUDID的器械类型,以下是GUDID截止于2024年8月28日的各项数据趋势解读。
1.GUDID记录和提交的合规日期
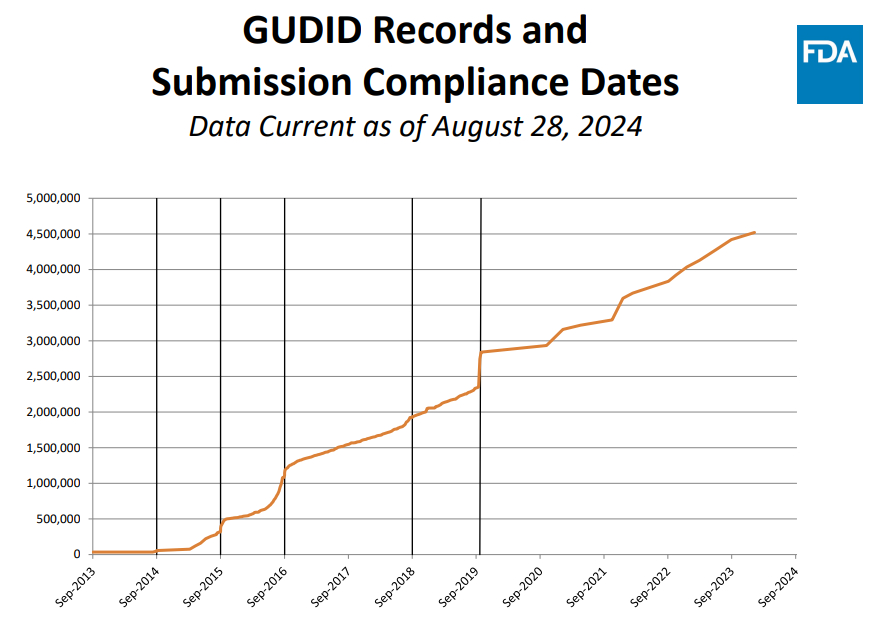
可见,GUDID记录逐月增长,截止2024年8月28日已近450万条。
2.GUDID的月度新增企业
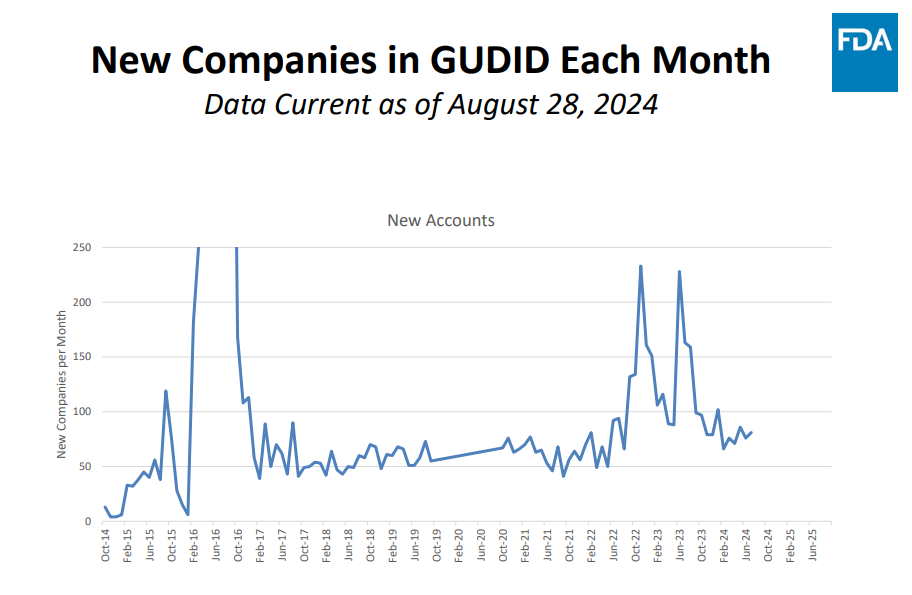
可见,截止2024年8月28日,GUDID新增企业同样呈现增长趋势。
3.GUDID贴标机所处的地理位置
美国以外,中国是UDI载体贴标数量最多的国家(之后依次为德国559、加拿大370、韩国368、英国341、以色列284、法国259、意大利253、日本193、瑞士165),足见中国企业出口美国的大部分产品均已被要求贴上UDI载体。
FDA早已强制要求:所有医疗器械需要向GUDID提交产品数据并且包装上具备UDI载体。FDA建立的全球UDI数据库GUDID Database,供公众查询以获得相应的器械信息。公众可直接在Access GUDID网页输入包装标签信息中的DI以找到产品信息,还可通过相应字段信息搜索(例:公司或商品名称\通用名称或器械型号\版本等)。
4.久顺经验分享:GUDID提交流程
①项目规划和团队组建
制造商指定固定人员进行UDI日常维护更新及登录GUDID数据库。
法规联络人Regulation Contact需完成UDI申请、创建GUDID账户、与FDA沟通、获得协调人Coordinator权限的账户。
标签管理人LDE User需录入用户账号LDE、GUDID录入、提交及管理产品标识UDI-DI信息。
②获得邓白氏码(D-U-N-S Number)
实时动态的企业身份标识,其不同申请类别对应时间周期为:
·常规申请,收到申请后30个工作日发码;
·加急3天,收到申请后3个工作日发码;
·加急24小时,收到申请后24小时后发码。
③确认UDI产品种类和数量
每个类别的器械及每个版本(针对软件)或每个种类的每个规格,都需要一个单独UDI。每种类型的医疗器械的每个尺寸、颜色、材料、样式和包装大小,同样需要一个单独UDI。
④获得GMDN(全球医疗器械术语系统)代码
⑤创建UDI-DI码
由器械标识符DI和生产标识符PI两部分组成。DI为固定编码,包含贴标企业的信息、设备特定版本或型号。
⑥申请GUDID账户
账户申请要求如下:
A.配合美代或外部公司填写申请表。
B.提供发码机构GS1中国的证书pdf版本。
C.提供含企业域名的法规联络人Regulation Contact邮箱。
D.申请中无需向FDA支付费用,但需确保企业FDA官网账户为活跃状态、FDA企业年金已支付并已由美代进行账户年度注册。
⑦数据库录入医疗器械关键信息
制造商需安排标签管理人将UDI记录及对应产品其他关键信息录入GUDID 数据库,需录入信息有:Identification、Regulatory、Packaging、Characteristics、Labeler、Production Control(注意针对UDI编码部分只需录入产品DI)。
解疑→GUDID操作难怎么办?
久顺是国内少数几家获FDA官方授权操作GUDID及UDI的美代公司。
针对美国UDI-DI创建、GUDID数据库账户创建、产品UDI信息输入GUDID数据库等,久顺提供高性价比贴心服务,同样费用、更优服务!却只要更少的时间:全系列流程完成最快只需15个工作日,时效与精准兼备足以傲视业界。





