近日,欧洲医疗技术协会(MedTech Europe)发布制造商声明模板,以方便制造商就法规(EU)2024/1860 及以下内容进行声明:
·根据指令98/79/EC(IVDD),符合性评估程序未要求公告机构参与的器械的过渡期延长和/或
·根据指令98/79/EC(IVDD)颁发的证书(指令证书)的有效性和/或
·遗留器械及其制造商是否符合继续投放市场和投入使用的条件。
所有体外诊断产品制造商均可自由使用该模板以自行作出上述声明,制造商在填表时应说明其声明符合适用条件的方式。
一、模板的内容组成
1.可选择适用的文本部分;
2.附表列出制造商计划在其声明中涵盖的器械。
模板部分截图内容如下:
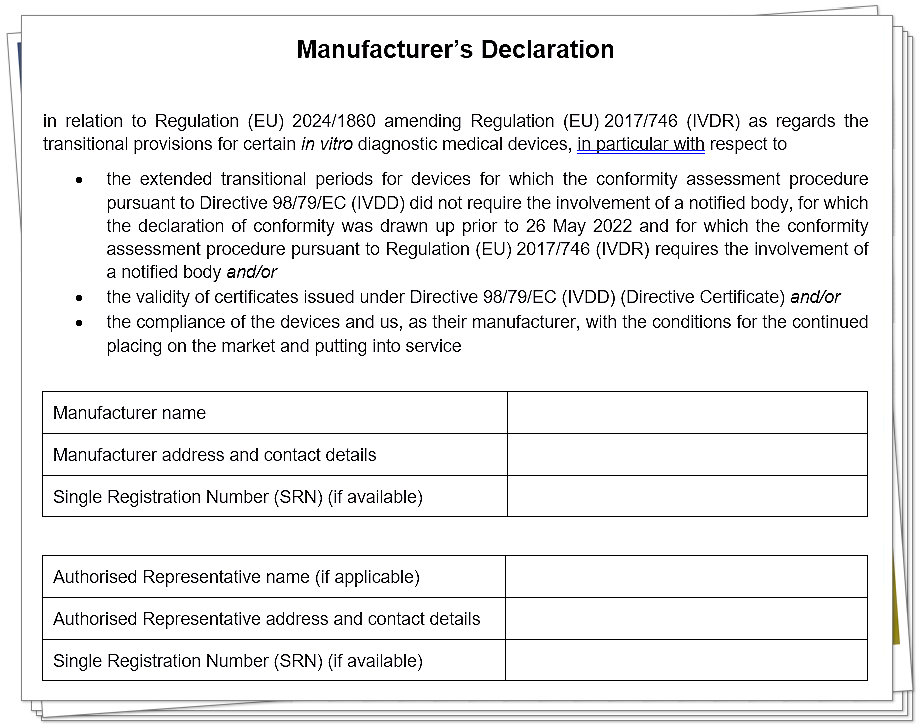
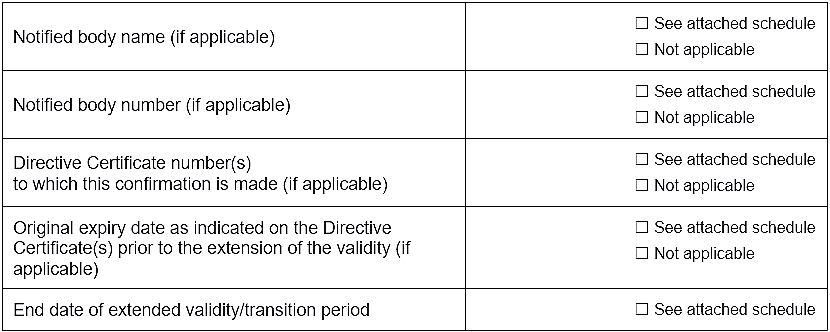
二、模板内容示例:制造商全权负责声明
- 附表所列器械符合IVDR第110.3b条所规定合法延长过渡期的条件,和/或
- 附表所列指令证书符合IVDR第110.2条所规定合法延长有效期的条件,和/或
- 附表所列器械及我方作为其制造商符合IVDR第110.3c条所列继续投放市场和投入使用的条件,即满足以下条件:
根据IVDD指令自我宣称但在IVDR下需要公告机构参与的器械,根据IVDD制定的合格评定程序无需公告机构参与,合格声明为2022年5月26 日前起草,而根据IVDR制定的合格评定程序需要公告机构参与的器械↘
选择一项适用的声明:
□我方已经或即将根据附件VII IVDR第4.3节第1段的规定,就附表所列器械或其替代品向公告机构提出正式的合格评定申请,申请时间不迟于↓
·D类--2025年5月26日;
·C类--2026年5月26日;
·B类和A类(无菌)--2027年5月27日。
□我方已经或即将根据附件VII IVDR第4.3节第2段的规定,就附表所列器械或其/替代品签署书面协议,申请时间不迟于↓
·D类--2025 年 9 月 26 日;
·C 类--2026 年 9 月 26 日;
·B类和A类(无菌)--2027年9月27日。
□我方不准备为附表中所示器械提出符合性申请。
备注:其他情况的宣称详见声明模板,久顺不在此一一列举。
重要提示
按照法规要求,制造商如需适用延期应当满足共性条件:已与公告机构签署认证合同。而签约前,公告机构往往都会要求制造商提供IVDR技术文档作为签约的前提条件。
因此,制造商提前准备IVDR技术文档是适用IVDR延期的当务之急!
此外Others器械延期还需满足“体系升级”条件!
欧盟CE技术文档编写、体系升级服务,久顺是您上上选!
久顺已为诸多制造商完成MDR/IVDR体系升级、公告机构体系监督审核中的MDR/IVDR发补意见,已建立完备的MDR\IVDR体系升级服务:GAP分析表、上市后监督系统、警戒系统等。
具体服务: 上市后监督计划PMS Plan;上市后性能/临床跟踪计划PMPF\PMCF Plan;趋势报告Trends Report;定期安全更新报告PSUR 等建立\执行\培训。
作为国内少有的配备IVDR法规\技术\数据分析领域专业团队的企业,久顺已与欧盟各主流实验室和医院建立合作,可提供临床性能研究(国内少有可胜任且使用EP文件研究)、可用性研究、上市后临床跟踪研究等高质高效服务。





