一、UDI的基本概念
伴随医疗器械数量的持续增长,跟踪和识别它们成为一项挑战,也是建立全球公认的唯一器械标识(UDI)系统的原因。
UDI是分配给医疗器械的唯一数字或字母数字代码,由两部分组成:器械标识(DI)和生产标识(PI)。
Dl是固定代码,用于标识器械的制造商、品牌和型号。
Pl是可变代码,包含批号、序列号和有效期等信息。
二、UDI的要求和时间表
□ 美 国
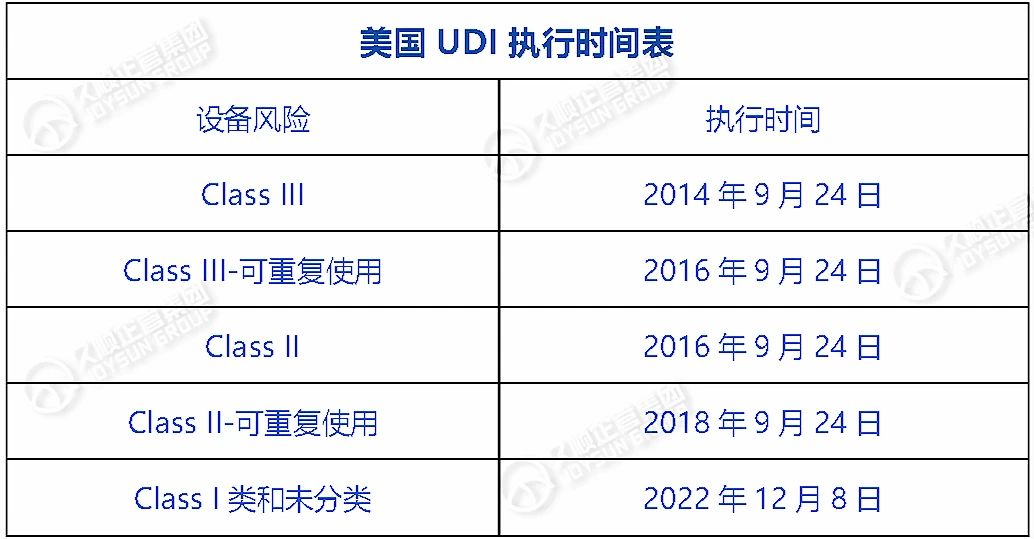
美国UDI系统由FDA于2013年建立。
FDA要求医疗器械制造商为其器械分配UDI,并提交给全球唯一器械识别数据库(GUDID)。
执行UDI法规的截止日期,根据器械的风险分类而有所不同,具体见下表↓
□ 欧 盟
欧盟UDI体系由欧盟委员会于2013年建立。
欧盟医疗器械法规(EU MDR)要求医疗器械制造商为其器械分配UDI,并提交给欧盟医疗器械数据库(EUDAMED)。
欧盟MDR设置过渡期,从2017年至2023年5月26日。过渡期已结束,制造商应当确保器械符合UDI要求后才可投放市场。
□ 加拿大
加拿大卫生部提出建立严格遵循IMDRF全球UDI指南的UDI系统。拟议的系统要求除I类低风险器械外的所有器械具备UDI标签。
加拿大卫生部计划创建新的UDI数据库或修改现有MDALL数据库,以纳入UDI信息。预计加拿大可能会根据其需求引入额外的UDI数据元素。
□ 澳大利亚
澳大利亚UDI系统由治疗用品管理局(TGA)于2019年建立。
医疗器械制造商必须为其器械分配UDI,并将其提交给澳大利亚医疗器械数据库(ADMD)。
UDI规定执行的截止日期为2022年7月1日,适用于III类和植入式器械,其他医疗器械适用的截止日期为2023年7月1日。
□ 日 本
日本UDI制度由厚生劳动省建立。
医疗器械制造商必须为其器械分配UDIs,并提交给日本医疗器械信息系统(J-Med Net)。
UDI规定执行的截止日期是2022年12月1日,适用于III类器械,适用于所有其他医疗器械的截止日期为2023年12月1日。
对医械制造商而言,知晓并遵守UDI适用要求以避免处罚并确保患者安全,显得尤为重要。
UDI创建难度不小:不用慌张,有久顺!
FDA UDI数据库申请和提交过程繁琐,操作难度不容轻视,制造商可放心交由久顺企管操作。作为国内少数获FDA官方授权操作GUDID及UDI的美代公司,针对美国UDI-DI创建、GUDID数据库账户创建、UDI信息输入GUDID等,久顺提供高性价比贴心服务,同样的费用、更优的服务,却只要更少时间:全程完成最快仅需15个工作日,更有:GUDID账户操作指南(久顺编制中英文版)、上传在线视频培训等多重好礼相赠。
以下为久顺UDI服务方案↓
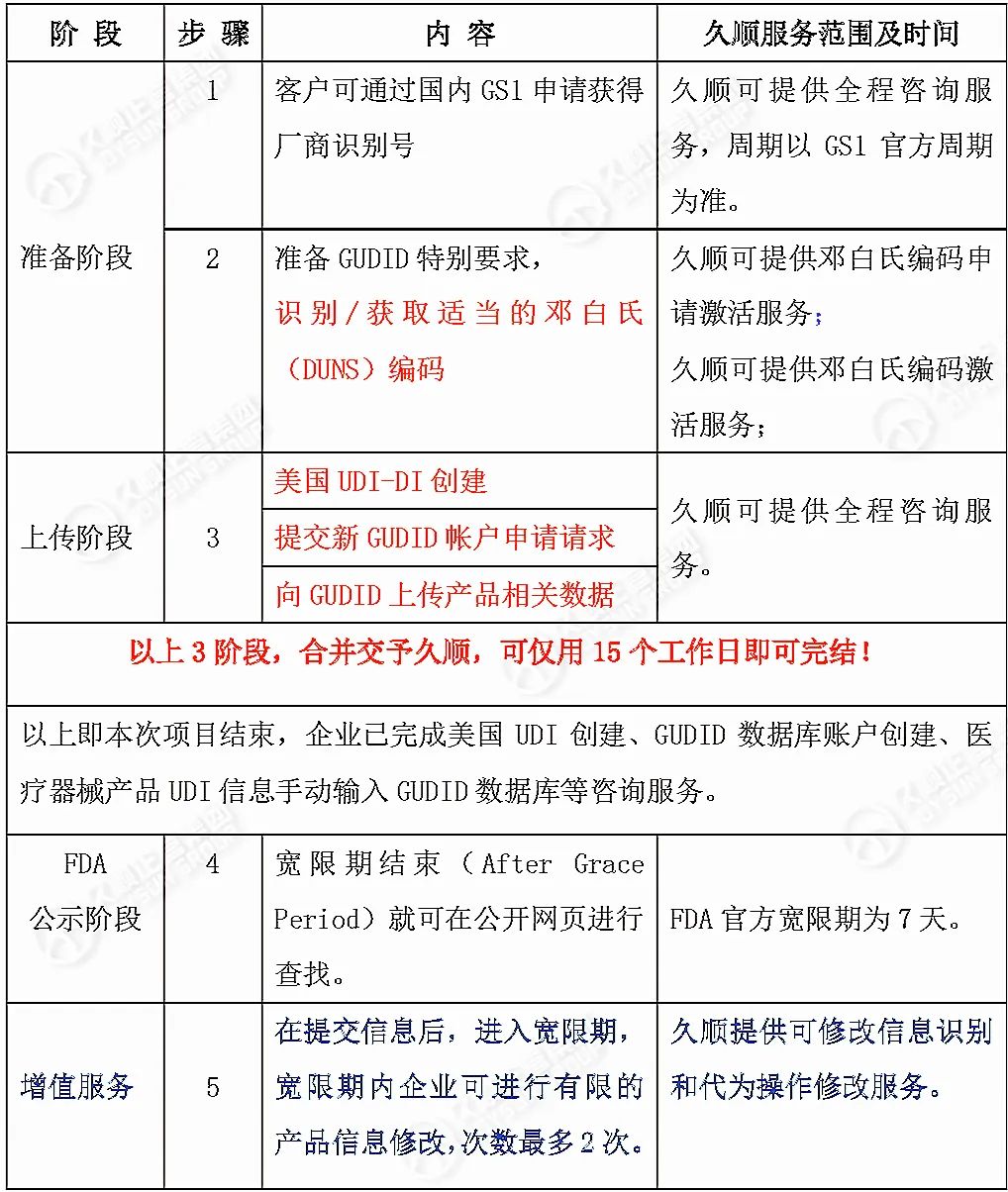
备注:如遇国外节假日会适当顺延。





