国内很多制造商都有将医疗器械分销到美国或欧洲市场的想法。众所周知,美国历来是医疗器械出口的一大目的国,对于意图进入美国市场械企而言,完成FDA市场认证审核前,应当先确保器械符合FDA对于医疗器械分类的要求,不同的分类要求往往对应不同的上市前提交申请和类型。
医疗器械分类的重要性
□ 便于制造商在产品开发阶段确定需求(尤其是设计控制);
□ 有助于制造商明确其销售产品前所必须完成的准备工作;
□ 有利于估算产品进入市场所需的总体成本和时间。
FDA的医疗器械分类规则
1.器械分类涉及医疗产品的预期用途intended use和使用适应症indication for use。具体定义如下:
□ 预期用途:描述对医疗器械的需求,指医疗器械的一般用途/功能。
□ 使用适应症:描述医疗器械所预防、诊断、治疗或缓解的疾病,包括目标人群。
医疗器械的预期用途和使用适应症,与制造商所需营销的产品理念有直接相关的联系。
2.FDA将医疗器械分为三类:Class I,II,III。
■ FDA对Class I医疗器械的定义:不用于支持或维持生命,也不用于预防对人类健康的损害,而且可能不会带来潜在的、不合理的疾病或伤害风险。
Class I产品对患者具有低至中度风险,应注意:Class I医疗器械与患者接触最小,不会接触患者的心血管系统、中枢神经系统或内脏。
Class I产品进入美国市场销售前,无需提交上市前通知申请(510k)或FDA批准(PMA)。但是,Class I产品需要制造商完成企业注册和产品列名。
■ FDA对Class II医疗器械的定义:一般的控制,不足以对器械安全性和有效性提供合理保障的器械。
Class II产品对患者具有中度至高度风险,由于持续性接触,其对患者带来相对更高的风险。Class II产品通常与患者的内脏或心血管系统及各种诊断工具接触。
■ FDA对Class III医疗器械的定义:通常用于维持或支持生命,被植入或具有潜在的、不合理的疾病或伤害风险,Class III产品对患者的风险最高。
美国医疗器械类别的确定方法
1.制造商获取类别信息最直接简便的方式是登录FDA官网查询。
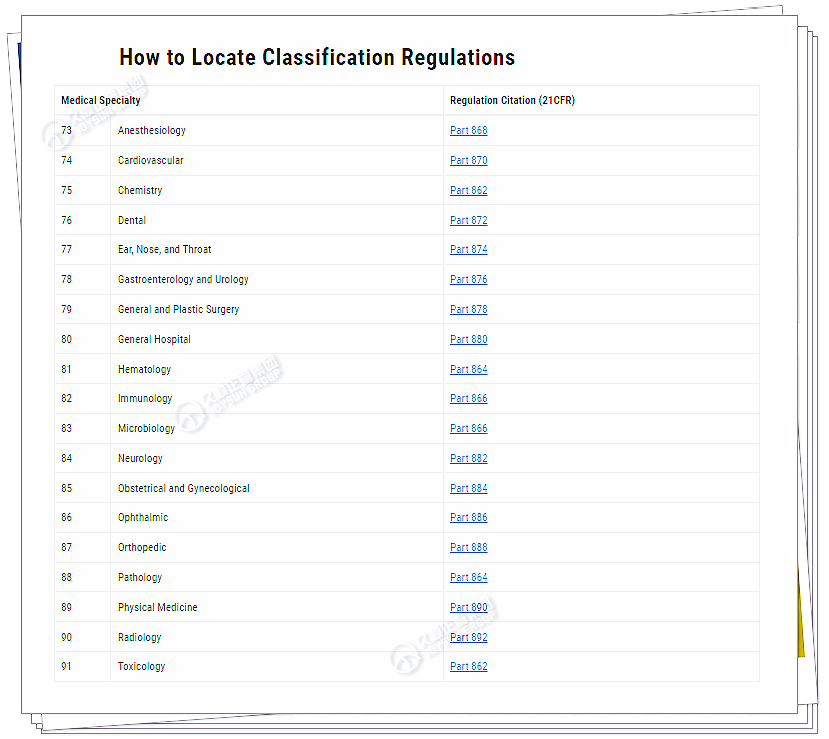
① 首先,可查看FDA的医疗器械分类面板(根据医疗专业划分的医疗器械类别列表)。
② 其次,必须找到与产品相关的FDA法规和产品代码。
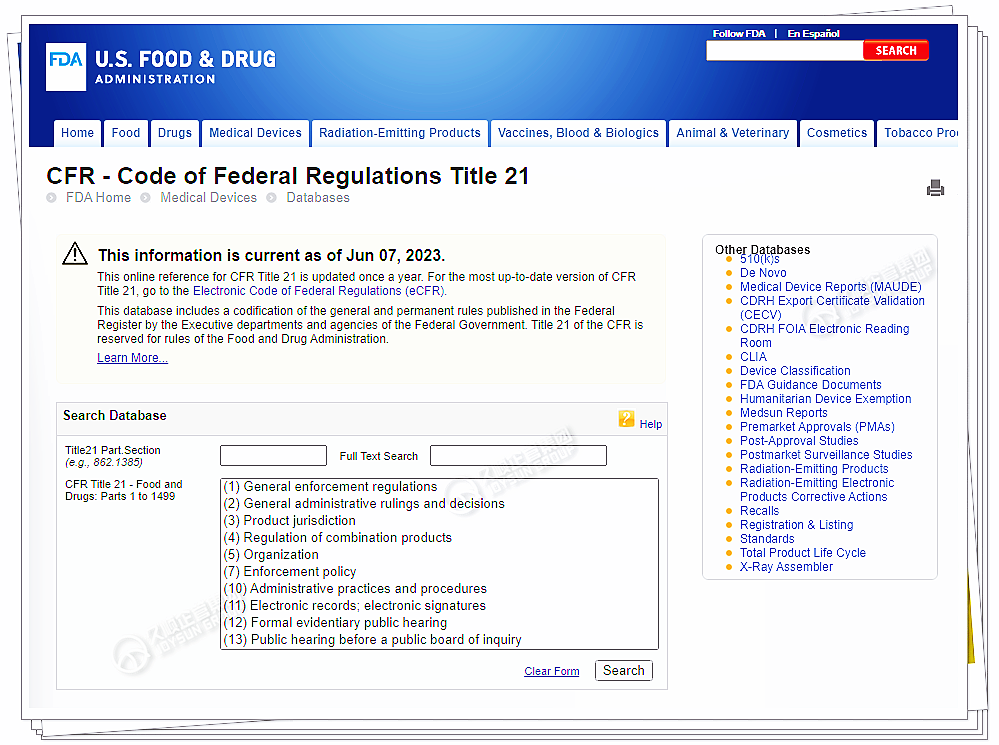
FDA的产品代码为5-7个字符,包含数字和字母。
③ 根据美国联邦法规第21篇-食品和药品:第862至892部分中的医疗专业,该机构有若干个医疗器械类别。
专业和法规编号的示例包括:
□ 862临床化学和临床毒理学器械
□ 864血液学和病理学器械
□ 866免疫学和微生物学器械
□ 868麻醉装置
□ 870心血管器械
2.确定美国医疗器械类别的其他方法有:
□ 制造商可通过电子邮件使用免费、保密和非正式的器械确定服务;
□ 提交F13(g)申请(正式且有约束力,需付费);
□ 寻求具备FDA注册全程咨询服务能力的机构合作(如:久顺企管集团)
# FDA注册全能帮手,当然→久顺企管!#
【久顺企管集团】近30年全球合规技术专家、资深美代,成员超80%本科、硕士、博士比例,具备海外留学经验,可无障碍英语口语和书面交流,呈献一站式高效率FDA合规服务:法规符合性咨询及培训、证书获取、性能研究方案编写、临床性能方案制定、临床试验实施、FDA验厂等。
FDA优势服务项目有:
1. FDA官网企业账户的年度注册、产品列名、产品上市前批准(510K、豁免510K),维持企业账户的活跃状态;
2. 邓白氏码查询、激活获取;
3. 产品分类、产品代码的查询配对;
4. 申请创建FDA UDI-DI、GUDID账户;
5. GUDID数据库录入医疗器械关键信息;
6. QSR820体系建立维护、FDA验厂咨询等。





