一、CE标志的作用
CE,全称CONFORMITE EUROPEENNE,即欧洲统一。
CE标志是一种安全标志,在欧盟市场中CE标志属于强制性认证标志,无论是欧盟国家或是其他国家企业生产,如果需要在欧盟市场流通,就必须加贴CE标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求,这是欧盟法律对产品提出的强制性要求。
二、CE标志的加贴要求
·CE标志应由字母缩写“CE”组成;
·若缩小或放大CE标识,应遵守上述渐变图的比例关系;
·CE标志的各组成部分应具有基本相同的垂直尺寸,其垂直尺寸不得小于5mm。对于小型器械,可以不考虑该最小尺寸。
三、CE标志适用的国家

提示:除美国FDA、日本PAL、澳大利亚TGA等之外,绝大多数国家通行使用欧洲颁发的自由销售证书CFS。
四、CE标志申请的常规步骤
步骤1. 根据欧盟医疗器械的定义,判定产品是否属于医疗器械;
步骤2. 根据产品的预期用途,确定该器械的分类等级;
步骤3. 选择相应的符合性评价程序;
步骤4. 选择咨询公司、检测机构和公告机构;
步骤5. 确认适用的基本要求/有关的协调标准;
步骤6. 确认该器械满足基本要求/协调标准, 并使证据文件化;
步骤7. 确定欧盟授权代表;
步骤8. 对需要公告机构评审的器械,通过公告机构的符合性程序;
步骤9. 起草符合性声明并加贴CE标志。
五、欧盟医疗器械法规

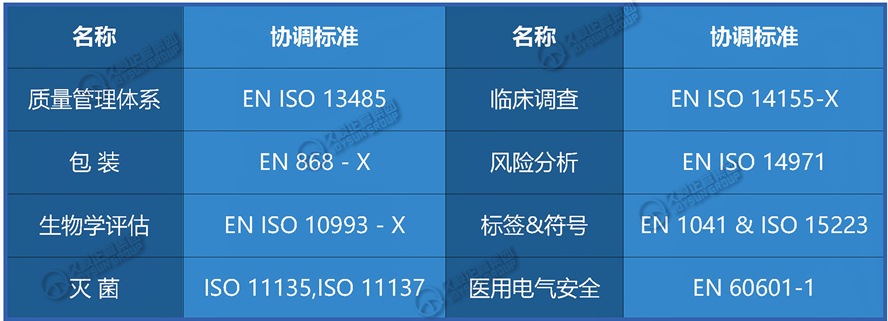
六、欧盟医疗器械协调标准
七、欧盟医疗器械通用规范
·Regulation (EU) 2022/2346
·Regulation (EU) 2022/2347
→欧盟MDR\IVDR拿证难度高、要求严、时间久,高效高速的合规准入服务是成败之关键!
【久顺企管集团】愿成为您合规道路的加速引擎!始创于1996年,近30年全球合规技术专家、近20年资深欧代,荷兰、英国、美国、中国均设公司。
> 呈献全程高效的欧盟合规服务:
√ 欧盟CE注册取证;
√ 技术文档编写;
√ 合规策略;
√ 体系辅导;
√ 上市后监督咨询;
>> 已成功布局欧盟临床试验渠道,提供欧盟临床试验一站式CRO服务:
√ 临床方案设计、临床试验方案的撰写;
√ 与当地实验室/医院合作,安排客户试验产品合规开展临床试验;
√ 包括但不限于:收集\整理\分析试验原始数据并出具临床试验报告。





