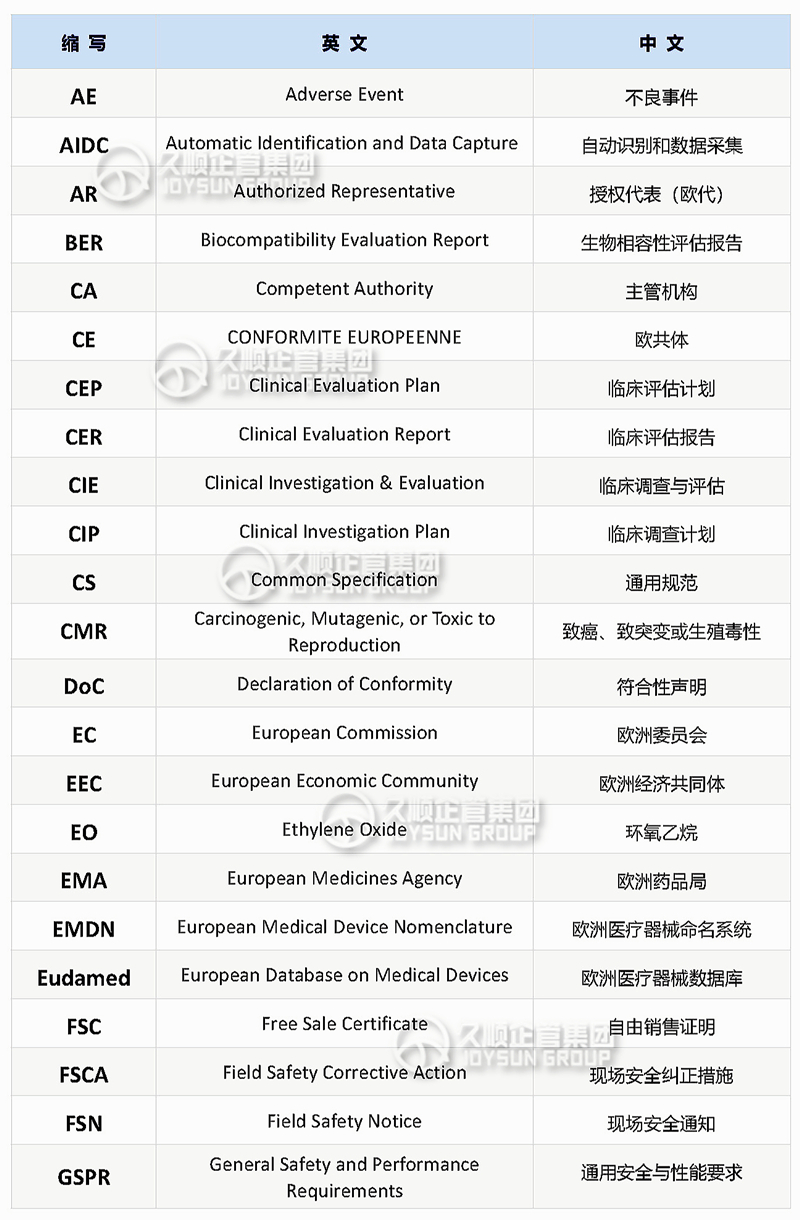
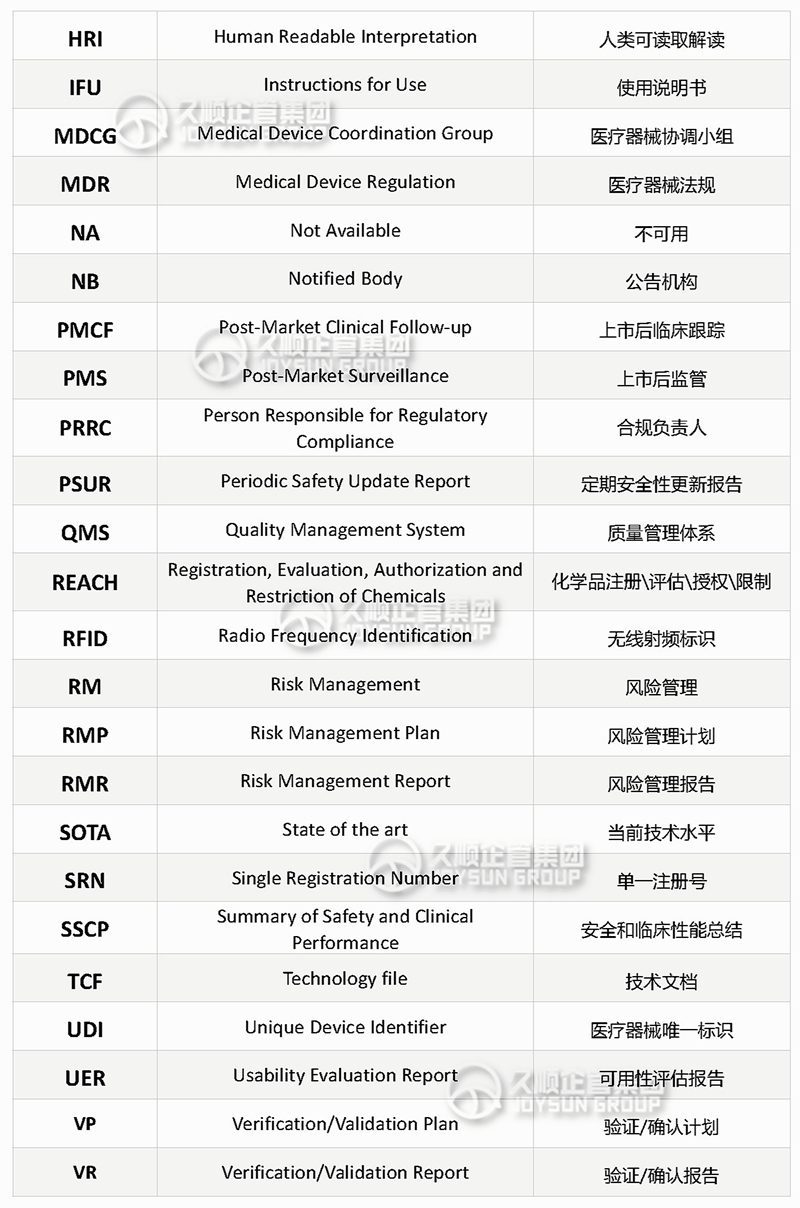
CE常用的英文缩写
与从事CE合规\认证注册的小伙伴沟通中发现,虽然他们在这行业已摸爬滚打多年,但对某些英文缩写仍未掌握其准确含义。
英文缩写或简写是简洁、高效的书写、沟通方式,尤其在国外盛行,不少国外机构审核员、采购或国外公司法规部人员都喜欢在交流和邮件中使用缩写和简称。
本期整理欧盟CE认证过程常用缩写,并按照26个字母的顺序排列,便于记忆和查阅。
CE申请前制造商应该做的9件事
1.确定市场
制造商需确定:预认证产品是否向欧盟市场销售?或预认证产品的目标市场是否认可CE?
2.分析产品
首先,制造商需要按预认证的产品预期用途,以确定:产品是否属于医疗器械?是否适合开展MDR认证?
其次,按照产品预期用途进行产品分类。
再者,选择该产品所属符合性评估途径。每种产品并非固定于同一种评估路径, 多数是有多种可选路径,其选择余地有大有小,建议尽量选择最合适的。
3.选择机构
制造商需确定合适的认证机构和咨询机构。各认证机构因为各自认证范围、人员配置、业务多少影响到制造商的认证进度,所以选择经验丰富、踏实可靠的咨询公司显得尤为重要。
4.寻找欧代
各国欧代在工作效率、业务范围、价格费用等因素上有着较大区别,建议谨慎选择。
5.UDI发码机构
确定合适的UDI发码机构,产品生产需具备数据载体 UDI carrier,并由专门的UDI发码机构分配。
6.质量管理体系
制造商需基于MDR要求建立、运行与保持质量管理体系。
7.CE技术文档
所有CE医疗器械都需准备CE技术文档。
8.SRN号
在EUDAMED数据库中登记,并取得SRN号。
9.递交认证申请
向选定的公告机构递交认证申请。
→ 欧盟MDR\IVDR拿证难度高、要求严、时间久,高效高速的合规准入服务是成败之关键!
【久顺企管集团】愿成为您合规道路的加速引擎!始创于1996年,近30年全球合规技术专家、近20年资深欧代,荷兰、英国、美国、中国均设公司。
> 呈献全程高效的欧盟合规服务:
√ 欧盟CE注册取证;
√ 技术文档编写;
√ 合规策略;
√ 体系辅导;
√ 上市后监督咨询;
>> 已成功布局欧盟临床试验渠道,提供欧盟临床试验一站式CRO服务:
√ 临床方案设计、临床试验方案的撰写;
√ 与当地实验室/医院合作,安排客户试验产品合规开展临床试验;
√ 包括但不限于:收集\整理\分析试验原始数据并出具临床试验报告。





